|

|
 |
|
|
고려대학교 안암병원 남명현
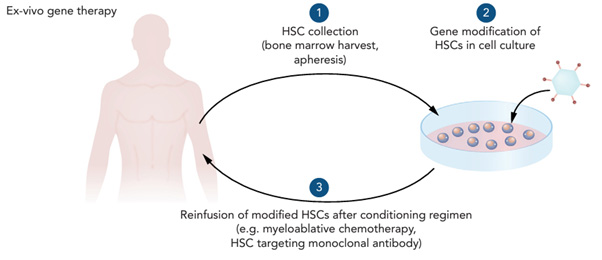
2023년 12월 8일 미국의 식품의약국(Food and Drug Administration, FDA)은 겸상적혈구질환(sickle cell disease, SCD)에 대한 두 개의 유전자 치료제를 승인하였다[1]. 두 치료제 모두 환자의 조혈모세포를 채취한 후 체외에서 SCD를 교정할 수 있는 유전자 조작을 시행한 후 이식하는 방법을 사용한다.
Casgevy (exagamglogene autotemcel, Vertex Pharmaceuticals Inc.)는 CRISPR/Cas9 유전자 편집기술을 이용하는데 SCD에 특이적인 돌연변이를 교정하는 방법이 아니라 정상인에서는 출생 후 6개월 이내에 사라지는 fetal Hb (HbF)을 증가시켜 SCD의 증상을 감소시키는 원리를 이용한다. Casgevy는 HbF를 증가시키기 위해 출생 후 γ-globin 생성을 억제하는 유전자인 BCL11A를 CRISPR/Cas9으로 조작하여 그 활성을 억제시키는 방법을 사용하며 CRISPR/Cas9 유전자 편집기술을 이용한 최초의 미국 FDA 승인 약제이다[3]. 이 원리는 β-지중해빈혈(thalassemia)의 치료에도 동일하게 적용될 수 있어 올해 β-지중해빈혈에 대해서도 미국 FDA 승인이 예상되고 있다. Lyfgenia (lovotibeglogene autotemcel, Bluebird Bio Inc.)는 lentivirus 벡터를 이용하여 채취된 조혈모세포에 유전자조작을 가하는 방법을 사용한다. 이 약제는 β-globin 유전자인 HBB gene의 87번째 코돈 threonine을 glutamine으로 치환하여(HbAT87Q) γ-globin의 antisickling 효과를 가져오게 된다. 이러한 방법으로 인위적으로 만들어진 돌연변이는 환자에게 존재하지 않는 것이므로 이 돌연변이의 발현 정도를 질량분석기 등으로 분석하면 치료효과를 추적 관찰할 수 있는 장점이 있다. 그러나 Lyfgenia를 투여받은 환자에서 혈액암 발생이 보고되었으므로 약제 label에 black box warning이 표시되었고 평생 혈액암 발생여부를 추적 관찰하도록 하고 있다. 겸상적혈구질환이 한국인에서 드물어서 위 두 유전자 치료제를 국내에서 사용할 경우는 거의 없을 것으로 생각되나, 최근 혈액질환 관련 유전자 치료제가 계속 등장하고 있고 앞으로도 수많은 치료제가 소개될 것으로 예측되므로 우리나라도 임상현장에서 혈액질환에 대한 유전자 치료제가 사용될 날이 멀지 않을 것이다. 현재 미국 FDA 승인된 약제로는 2022년 8월에 β-지중해빈혈 유전자 치료제로 승인된 Zynteglo (betibeglogene autotemcel, Bluebird Bio Inc.), 2022년 11월에 B형 혈우병 유전자 치료제 Hemgenix (etranacogene dezaparvovec, CSL Behring Inc.), 2023년 6월에 A형 혈우병 유전자 치료제 Roctavian (valoctocogene roxaparvovec, BioMarin Pharmaceutical Inc.) 등이 있고, 다양한 혈액 유전질환에 대한 임상시험이 진행되고 있으므로 향후 새로운 유전자 치료제의 등장은 점차 가속화될 것이다. 검사실에서는 이러한 치료제를 사용한 환자의 검사결과가 기존과 변화할 수 있음을 숙지해야 할 것이며 약제에 따른 추적검사 기법 등을 마련하여 임상의 요구에 대비해야 할 것으로 생각된다. 이러한 유전자 치료제는 단회 투여로 완치를 기대할 수 있어 기존과는 전혀 다른 개념의 치료 기회를 환자와 임상의에게 제공할 수 있다. 기존에 대증요법으로 평생 약물을 투여 받고 증상의 악화를 반복하는 난치성 혈액 유전질환 환자들에게 유전자 치료제의 등장은 완치되어 정상인으로 살아갈 수 있다는 희망을 주고 있다. 다만 이 치료제의 개발에 천문학 적인 투자가 필요해 약제 가격이 개인으로서는 감당하기 어려운 초고가(Hemgenix 1회 투여 350만 달러, Zynteglo 280만 달러, Roctavian 290만 달러 등)인 경우가 많아서 가격 때문에 치료를 받지 못하는 윤리적인 문제가 발생하고 있고, 건강보험 적용 등은 사회적인 합의 등이 필요하여 새로운 유전자 치료제가 등장할 때 마다 많은 논란이 예상된다. 참고문헌:
|
Copyright © The Korea Society for Laboratory Hematology. All Rights Reserved.
|