|
European LeukemiaNet (ELN) risk stratification and measurable residual disease in AML
충북대학교병원 박희수
1. 배경
European LeukemiaNet (ELN)는 현재 44개국 220 기관 1,000여명의 연구자 및 임상의가 주축이 되어 다양한 혈액종양질환의 진료가이드라인을 제시하고 있다. 2022년 성인 급성골수성백혈병에 대한 진단 및 치료에 대해 새로운 가이드라인을 Blood지에 발표하였는데, 여기에는 새로운 진단분류체계, 진단과정, 위험도분류, 미세잔존질환(measurable residual disease) 모니터링, 치료 후 반응판정, 치료, 임상시험 등 다양한 내용을 다루고 있다. 새로운 진단분류체계는 International Consensus Classification (ICC)에서 발표한 ‘myeloid neoplasms and acute leukemias’에 진단분류에 따라서 기술되었다. 이번 호에서는 이 중 위험도분류와 미세잔존질환모니터링에 관한 내용을 다루고자 한다.
2. 위험도 분류(Risk classification)
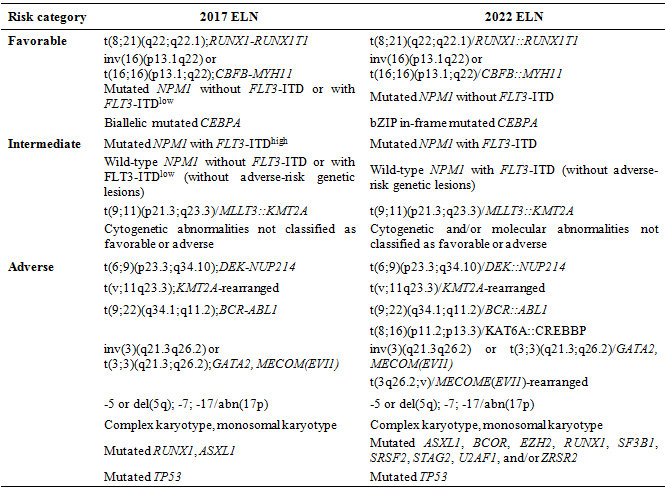
2022년 가이드라인에서도 2017년도 마찬가지로 3-risk group 분류체계: favourable, intermediate, adverse)를 사용하고 있다. 2017년도 가이드라인에 비해서 바뀐 점은 아래와 같다(Table 1).
(1) FLT-ITD allele ratio가 더 이상 위험도 분류에 고려되지 않는다. 2017년도 가이드라인에서는 FLT3-ITD allelic ratio가 0.5미만으로 낮을 경우 변이가 없는 환자군과 유사하게 좋은 예후를 보인다고 하여 이를favourable-risk 그룹에 포함시켰고, 0.5이상일 경우에는 adverse-risk 그룹으로 분류하였었다. 하지만 2022년도에는 AML with FLT3-ITD (without adverse-risk genetic lesion)은 intermediate-risk group에 속하게 되며, 이 때 allelic ratio나 NPM1 유전자변이의 동시검출 여부는 중요하지 않다. 이는 FLT3-ITD allelic ratio의 정량에 있어 검사기법의 표준화가 되어 있지 않고, AML with FLT3-ITD without NPM1 mutation 에서 FLT3-ITD allelic ratio에 따른 midostaurin 치료 효과 가 유사한 점, 그리고 치료 중 미세잔존질환의 중요성의 증가에 따른 것이다.
(2) AML with myelodysplasia-related gene mutation은 adverse-risk 그룹으로 분류되었다. 이들은 myelodysplasia-related cytogenetic abnormalities가 없는 경우에도 de novo 혹은 선행된 혈액종양질환 기왕력 있는 AML에서 모두 예후가 좋지 않았다. 여기에는 총 9개 유전자 ASXL1, BCOR, EZH2, RUNX1, SF3B1, SRSF2, STAG2, U2AF1, ZRSR2 가 포함된다.
(3) NPM1 mutated AML에서 adverse-risk cytogenetic abnormalities 가 있는 경우 adverse risk 그룹으로 분류되었다. 하지만 other genetic abnormalities(예를 들면 myelodysplasia-related gene mutation)이 있는 경우에도 예후가 좋지 않은지에 대한 여부는 좀 더 연구가 필요하다.
(4) CEBPA 유전자의 basic leucine zipper region에 영향을 주는 in-frame mutation은 예후가 좋으며, biallelic 또는 monoallelic의 여부는 중요하지 않다.
(5) Recurring cytogenetic abnormalities에 포함된 MECOME gene과 연관된 t(3q26.2;v) 또는 t(8;16)(p11.2;p13.3)/KAT6A::CREBBP gene fusion은 adverse-risk 그룹에 추가되었다.
(6) Hyperdiploid karyotype with multiple trisomies는 더 이상 complex karyotype에 포함되지 않고 adverse risk 그룹에서도 제외되었다.
Table 1. ELN 2017년과 2022년도 비교
3. 미세잔존질환 모니터링(Monitoring of measurable residual disease, MRD)
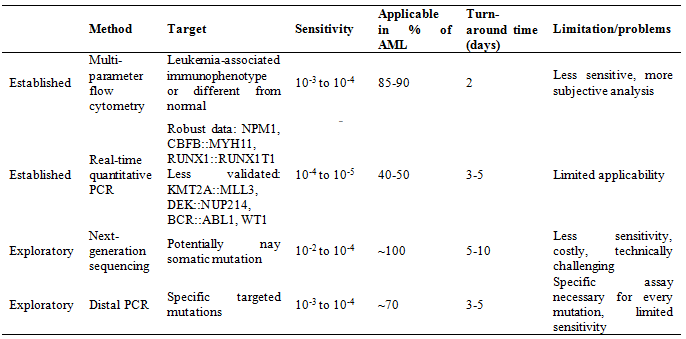
급성골수성백혈병에서 미세잔존질환 모니터링은 완전관해상태를 확인하고 재발의 위험도를 평가할 수 있다. 두 가지 방법으로 시행할 수 있는데, 유세포검사(mutiplarameter flow cytometry-based MRD, MFC-MRD)과 정량중합효소연쇄반응기법(quantitative PCR, qPCR)을 이용한 분자진단검사(molecular MRD, Mol-MRD)가 있다(Table 2). 유세포검사는 다양한 면역표현형을 분석해 일반적인 정상모세포와 다른 급성골수성백혈병의 특성을 찾아내는 것이 중요하다. 이 검사는 높은 민감도와 낮은 위음성을 보인다. 분자검사는 qPCR과 디지털PCR (digital PCR)을 이용할 수 있는데 최소검출한계가 10-3에 다를 수 있다. 말초혈액이나 골수 검체 모두 사용 가능하지만 골수 검체가 좀 더 민감도가 높다. 검출에 사용되는 유전자는 NPM1; CBFB::MYH11, RUNX1::RUNX1T1, KMT2A::MLL3, DEK::NUP214, BCR::ABL1 gene fusion;과 WT1 expression이 있다. 이 때 생식세포변이(germline mutation) 는 제외 시켜야 하며, 전암상태(premalignant clonal hematopoiesis )에서 많이 검출되는 DNMT3A, TET2, ASXL1 은 제외를 고려해야 한다.
Table 2. Methods for detection of MRD in AML
미세잔존질환 모니터링을 시행하는 시점에서는 유전자변이에 따라서 다르게 고려되어야 한다(Figure 1). 검체는 골수 혹은 말초혈액을 사용할 수 있으며, 측정된 미세잔존질환 양에 따라서 치료방향을 결정할 수 있다. 예를 들어 집중항암치료 후 미세잔존질환 양이 2% 이상이거나 log 3-4 이상의 감소가 되지 않을 경우 동종조혈모세포이식 등의 대안을 고려해 볼 수 있다. 또한 2 주기 집중항암치료 후에도 미세잔존질환 양성인 경우에도 치료변경을 고려해볼 수 있다.
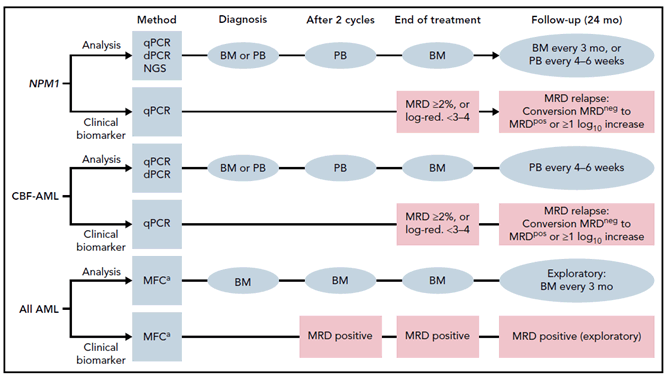
Figure 1. Algorithm of MRD assessment and time points at which MRD is considered clinically relevant biomarker
참고문헌
- Döhner H, Estey E, Grimwade D, Amadori S, Appelbaum FR, Büchner T, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood, The Journal of the American Society of Hematology 2017;129:424-47.
- Döhner H, Wei AH, Appelbaum FR, Craddock C, DiNardo CD, Dombret H, et al. Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN. Blood, The Journal of the American Society of Hematology 2022;140:1345-77.
- Arber DA, Orazi A, Hasserjian RP, Borowitz MJ, Calvo KR, Kvasnicka H-M, et al. International Consensus Classification of Myeloid Neoplasms and Acute Leukemias: integrating morphologic, clinical, and genomic data. Blood, The Journal of the American Society of Hematology 2022;140:1200-28.
|
