골수계종양(myeloid neoplasm)의 분류 개정안
: 세계보건기구(World Health Organization, WHO) 분류 제5판과 국제합의분류(International Consensus Classification, ICC)의 비교
서울대학교병원 진단검사의학과 장윤환
1. 배경
2022년에 골수계종양(myeloid neoplasm)의 분류 개정안이 발표되었는데, 이전과는 다르게 두 가지 안이 2개월 간격으로 발표되어 혼선을 주고 있다. 2022년 7월에 Leukemia지에 세계보건기구(World Health Organization, WHO) 분류 제5판 개정안이 실렸고, 2022년 9월에는 Blood지에 국제합의분류(International Consensus Classification, ICC)가 발표되었다. 자세한 내막은 확실하지 않으나 ICC 발표 그룹에서 주장한 내용에 따르면, 그동안의 WHO 혈액종양 및 림프계종양 분류 제3판(2001), 제4판(2008), 개정4판(2016)은 수많은 병리학자, 혈액학자, 종양학자, 유전학자로 구성된 임상자문위원회(clinical advisory committee, CAC) 의견에 기초한 WHO와 혈액병리학회(Society for Hematopathology, SH) 및 유럽혈액병리학회(European Association for Haematopathology, EAHP)의 협업의 산물이었는데, 국제암연구소(International Agency for Research on Cancer, IARC)가 계획한 제5판 blue book 시리즈는 SH 및 EAHP의 관리 감독이 부족했으며 CAC 프로세스를 따르지 않았다고 한다. 결국에는 WHO와 별도로 SH와 EAHP가 공개적으로 지지한 CAC가 이전 분류를 업데이트하기 위해 개최되었고 ICC를 발표하기에 이르렀다. 향후 이러한 두 가지 안이 공존하는 상황이 어떻게 전개될지는 현재로서는 예측하기 어려우며, 일단 두 가지 개정안을 비교하여 주요 변경 내용에 대해 간략하게 소개하고자 한다. 지면 관계상 모든 질환의 내용을 담지는 않았으며, 질환별 자세한 진단기준은 생략하였다.
2. 전암상태(premalignant state)
Clonal hematopoiesis of indeterminate potential (CHIP)과 clonal cytopenia of undetermined significance (CCUS)가 공식적으로 정의되었으며, 이 때 사용되는 혈구감소증(cytopenia)의 정의가 변경되었다. 절대중성구수 감소 기준은 1.8×109/L 미만으로 변동이 없으며, 빈혈 기준은 이전에는 10 g/dL 미만이었으나 남성은 13 g/dL 미만, 여성은 12 g/dL 미만으로 변경되었다. 혈소판 감소 기준은 이전에는 100×109/L 미만이었으나 150×109/L 미만으로 변경되었다. 이러한 기준은 WHO와 ICC 개정안에서 모두 동일하다.
WHO 개정안의 clonal hematopoiesis, CHIP 및 CCUS의 정의는 다음과 같다.

ICC 개정안의 내용도 이와 유사하나, CHIP 정의에서 ‘variant allele fraction (VAF) ≥4% for X-linked gene mutations in males’ 내용이 없으며, ‘somatic mutation in a myeloid neoplasm driver gene (at VAF ≥2%)’외에 ‘non–MDS-defining clonal cytogenetic aberration’이 추가되었다. 또한 CCUS 정의에서 persistent cytopenia의 기간을 ‘4개월 이상’으로 명시하였다.
3. 골수증식종양(myeloproliferative neoplasm, MPN)
1) ‘Chronic myeloid leukemia (CML), BCR::ABL1-positive’는 ‘chronic myeloid leukemia’로 간략하게 명칭이 변경되었다.
2) WHO 개정안에서는 CML의 accelerated phase를 삭제하였으나, ICC 개정안에서는 종전과 같이 accelerated phase가 존재한다.
3) WHO 개정안의 chronic eosinophilic leukemia (CEL)의 진단기준에서 hypereosinophilia의 지속 기간이 종전의 6개월에서 4주로 단축되었으며, blast 증가 기준(혈액에서 2% 이상 또는 골수에서 5-19%)이 삭제되었다. 그러나 ICC 개정안의 chronic eosinophilic leukemia, not otherwise specified (CEL, NOS) 진단기준에는 blast 증가 기준(말초혈액에서 2% 이상 또는 골수에서 5% 이상)이 그대로 남아있다.
4) Juvenile myelomonocytic leukemia (JMML)는 germline pathogenic gene variant와 연관있는 경우가 많으며, 두 가지 분류 모두에서 종전의 myelodysplastic/ myeloproliferative neoplasm (MDS/MPN) category에 넣지 않은 점은 동일하나, 개정된 category는 두 분류에서 큰 차이가 있다. WHO 개정안에서는 소아 시기의 MPN으로 분류되었으며, ICC 개정안에서는 'Pediatric and/or germline mutation-associated disorders'로 분류되었다.
4. 비만세포증(mastocytosis)
두 가지 분류 모두에서 mastocytosis의 minor diagnostic criteria에 CD30과 any KIT mutation이 포함되었으며, WHO 개정안에서는 KIT D816V mutation with variant allele frequency (VAF) ≥ 10%이 B-finding에 포함되었다.
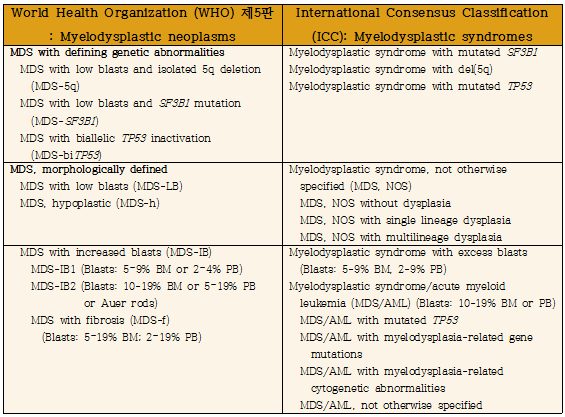
5. 골수형성이상증후군(myelodysplastic neoplasm or myelodysplastic syndrome, MDS)
1) ICC 개정안에서는 종전과 같이 ‘myelodysplastic syndrome’을 사용하나, WHO 개정안에서는 ‘myelodysplastic neoplasm’으로 명칭이 변경되었으며, 약어는 종전과 같이 ‘MDS’를 그대로 사용한다.
2) WHO 개정안에서는 MDS를 ‘MDS with defining genetic abnormalities’와 ‘MDS, morphologically defined’ 두 군으로 나누었고 ‘MDS, morphologically defined’군은 크게 ‘MDS with low blasts (LB)’군과 ‘MDS with increased blasts (IB)’군으로 나눌 수 있다.
3) ICC 개정안은 큰 맥락에서 보면 WHO 개정안의 ‘MDS with defining genetic abnormalities’, ‘MDS with low blasts’, ‘MDS with increased blasts’라는 틀에서 크게 벗어나지 않는 것처럼 보이지만, 세부적인 명칭과 분류에서 차이를 보인다. ‘MDS without excess blasts’군은 lower-risk MDS로서 주로 genetic feature로 정의되는 두 군[SF3B1 mutation and del(5q)]과 나머지 MDS, not otherwise specified (NOS)군으로 분류된다.
4) WHO 개정안에서는 MDS with low blasts에서 single lineage와 multilineage dysplasia의 구분은 '선택적(optional)'이라고 하였으며, ICC 개정안에서는 MDS, NOS에 single lineage와 multilineage dysplasia 외에 'without dysplasia'도 추가되었다.
5) WHO 개정안에서는 골수 blast 5% 이상 또는 말초혈액 blast 2% 이상일 때 ‘MDS with excess blasts (EB)’였던 것이 ‘MDS with increased blasts (IB)’로 명칭이 변경되었다. ICC 개정안에서는 ‘MDS with excess blasts’ 명칭을 그대로 사용하나, 이전의 MDS-EB-1과 유사하며 말초혈액 blast 기준(2-9%)만 차이가 있다. 이전의 MDS-EB-2는 ‘myelodysplastic syndrome/acute myeloid leukemia (MDS/AML)’로 변경되었으며, MDS/AML는 'cytopenic myeloid neoplasm and 10% to 19% blasts in the blood or bone marrow'로 정의하였다. 단, 이는 성인에 해당되는 것이고, 18세 미만의 소아 및 청소년에서는 혈액이나 골수에서 10-19% blast인 경우 이전처럼 MDS-EB로 분류된다.
6) 그동안 MDS와 AML을 구분하여 정의하는 20% blast cutoff는 임의적이고 발병기전에서의 생물학적 연속성을 반영하지 못한다는 비판을 받아왔다. 임상시험에서도 이러한 숫자에 묶여 어느 한쪽에만 적용할 수 밖에 없는 한계점이 있었다. WHO 개정안에서는 대부분의 AML with defining genetic alterations에서는 blast 20% 기준을 삭제하고 10%로 낮추었으나, MDS와 AML을 구분하여 정의하는 20% blast cutoff 자체는 유지하였다. ICC 개정안에서는 ‘MDS/AML’ 용어를 사용함으로써 사실상 AML 기준을 10%로 낮추었으나 WHO 개정안에서는 임의적으로 AML 기준을 10%로 낮추는 것에 대해 과잉치료(overtreatment)의 위험성에 대한 우려를 표명하였다.
7) WHO 개정안에서 MDS-5q 진단은 SF3B1 또는 TP53 mutation (not multi-hit)에 우선하며, MDS with biallelic TP53 inactivation (MDS-biTP53) 진단은 MDS-5q과 MDS-SF3B1에 우선한다. 약간의 용어 및 정의의 차이는 있으나 이러한 우선순위는 ICC 개정안에서도 동일하게 적용됨을 알 수 있다.
8) WHO 개정안에서 'MDS with low blasts and ring sideroblasts'라는 용어는 'wild-type SF3B1 and ≥15% ring sideroblasts'인 경우에 사용하기에 적합한 용어로서 남아있다. 하지만 ICC 개정안에서는 ‘SF3B1-unmutated MDS-RS’의 경우 MDS with single or multilineage dysplasia와 유사한 임상 양상과 치료 결과를 나타내어 ring sideroblast 수에 상관없이 MDS, NOS로 분류하고 있다.
9) WHO 개정안에서는 'MDS, morphologically defined' category 내에 MDS, hypoplastic (MDS-h)과 MDS with fibrosis (MDS-f)를 별도의 진단명으로 넣었으나, ICC 분류에서는 이에 대한 언급이 없다.
10) WHO, ICC 개정안 모두에서 MDS, unclassifiable (MDS-U)은 삭제되었다. ICC 개정안의 ’MDS, not otherwise specified (NOS)’가 종전의 MDS-U와 혼동을 줄 수 있는데, MDS-U와는 전혀 다르며, ‘MDS without excess blasts (lower-risk MDS)’의 의미이다.
Table 1. Classification of myelodysplastic neoplasms or myelodysplastic syndromes (MDS)
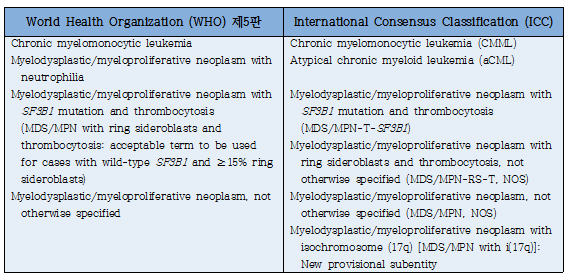
6. 골수형성이상/골수증식종양(Myelodysplastic/myeloproliferative neoplasm, MDS/MPN)
1) WHO 개정안에서 chronic myelomonocytic leukemia (CMML)의 진단기준은 필수기준(prerequisite criteria)과 보조기준(supporting criteria)으로 나누었는데, 필수기준 중 absolute monocytosis의 기준이 종전의 1.0×109/L에서 0.5×109/L로 낮아져 소위 'oligomonocytic CMML'에 속하던 군이 포함되었다. 단, CMML의 진단정확도를 향상시키기 위해 absolute monocytosis가 ≥0.5×109/L이지만 <1.0×109/L인 경우에는 1개 이상의 clonal cytogenetic 또는 molecular abnormality와 1개 lineage 이상의 dysplasia 기준을 충족해야 한다. 현저한 임상적, 유전적 특징을 가진 두 가지 질병 아형이 백혈구 수에 따라 myelodysplastic CMML (MD-CMML) (WBC <13×109/L)과 myeloproliferative CMML (MP-CMML) (WBC ≥13×109/L)로 공식적으로 분류되었으며, CMML-0 (말초혈액 blast <2%, 골수 blast <5%)는 예후적 의미가 없거나 제한적이어서 삭제되었다.
2) ICC 개정안의 CMML 진단 기준에서는 필수기준과 보조기준으로 나누지는 않았지만 내용은 유사하다. Absolute monocytosis의 기준이 0.5×109/L로 낮아진 것은 WHO 개정안과 동일하며, clonality의 증거가 없는 경우 다음 조건을 만족해야 한다: monocytes ≥1.0 ×109/L and >10% of the WBC, and increased blasts (including promonocytes: BM ≥5%, and/or PB ≥2%), or morphologic dysplasia, or an abnormal immunophenotype consistent with CMML.
3) Atypical chronic myeloid leukemia (aCML)은 ICC 개정안에서는 ‘BCR::ABL1 negative’만 삭제되고 명칭을 유지하였으나, WHO 개정안에서는 CML과의 혼동을 피하고 MDS/MPN의 특성을 강조하기 위함이라는 이유로 ‘MDS/MPN with neutrophilia’로 명칭이 변경되었다.
4) 두 분류 모두에서 MDS/MPN with ring sideroblasts and thrombocytosis는 SF3B1 mutation에 근거하여 ‘MDS/MPN with SF3B1 mutation and thrombocytosis’로 명칭이 변경되었다. 하지만 WHO 개정안에서 ‘MDS/MPN with ring sideroblasts and thrombocytosis’라는 용어도 ‘wild-type SF3B1 and ≥15% ring sideroblasts’ case에 적용할 수 있는 용어로 남아있으며, ICC 분류에서는 이러한 경우 ‘MDS/MPN-RS-T, NOS’라고 부른다.
5) MDS/MPN, unclassifiable은 ‘MDS/MPN, not otherwise specified’로 명칭이 변경되었으며, WHO 개정안에서는 이를 전체 분류에서 ‘unclassifiable’이라는 역설적 수식 어구(paradoxical qualifier)를 제거하기 위함이라고 하였고, ICC 개정안에서는 단지 배제진단이 아닌 명확한 진단기준이 있는 disease entity라고 하였다. ICC 개정안에서는 ‘MDS/MPN with isochromosome (17q)’가 MDS/MPN, NOS의 provisional subentity로 새롭게 추가되었다.
6) 앞에서도 언급한 바와 같이 Juvenile myelomonocytic leukemia (JMML)는 두 가지 분류 모두 MDS/MPN category에서 제외되었으며, WHO 개정안에서는 MPN으로, ICC 개정안에서는 'Pediatric and/or germline mutation-associated disorders'로 분류되었다.
Table 2. Classification of myelodysplastic/myeloproliferative neoplasm (MDS/MPN)
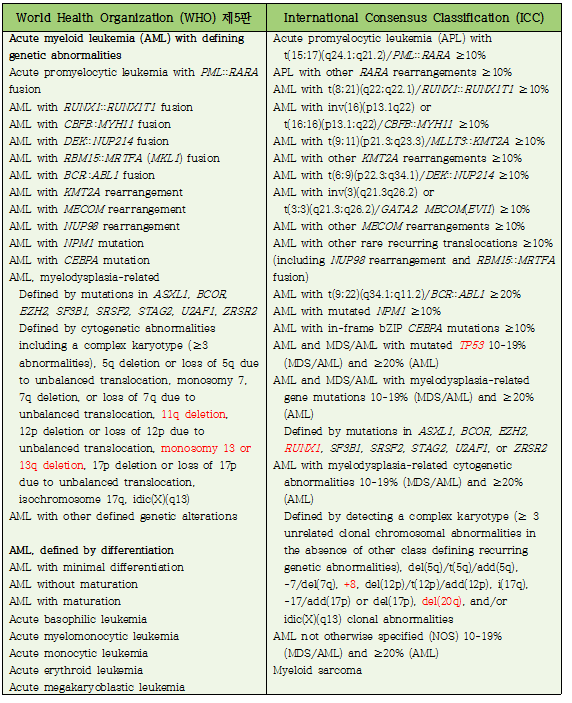
7. 급성골수백혈병(acute myeloid leukemia, AML)
1) WHO 개정안에서는 AML을 크게 ‘AML with defining genetic abnormalities’와 ‘AML, defined by differentiation’의 두 군으로 나누어 WHO 개정4판에서의 AML not otherwise specified (NOS)의 형태학적 아형이 ‘AML, defined by differentiation’군 안에 대부분 남아있으나, ICC 개정안에서는 ‘AML not otherwise specified (NOS)’ 명칭을 그대로 유지하면서 형태학적 아형은 예후적 의의에 한계가 있기는 하지만 판독의가 원한다면 분류할 수 있다고 하였다. 즉, 전체적으로 ICC 개정안이 유전학적 정의를 더 강조하고 있다.
2) ‘AML with defining genetic abnormalities’에 해당하는 질환을 표기할 때 ICC 개정안에서는 WHO 개정4판에서와 같이 'AML with t(8;21)(q22;q22.1)/RUNX1::RUNX1T1'의 형태로 염색체 이상과 유전자 이상을 함께 표기하였으나, WHO 개정안에서는 'AML with RUNX1::RUNX1T1 fusion'의 형태로 염색체 이상을 표기하지 않고 유전자 이상만으로 간결하게 표기하였다.
3) WHO 개정안의 ‘AML defining genetic abnormalities’에서는 blast가 20% 이상인 경우와 20% 미만인 경우의 임상 양상이 유사하여 AML with BCR::ABL1 fusion과 AML with CEBPA mutation을 제외하고는 blast 20% 이상 기준이 삭제되었다. AML with BCR::ABL1 fusion은 CML과 혼동을 피하기 위해서, AML with CEBPA mutation은 blast 기준을 낮출 수 있는 것을 뒷받침하는 data가 불충분하여 blast 20% 이상 기준이 유지되었다. ICC 개정안에서도 대부분의 genetic abnormalities를 나타내는 AML 아형에서 blast 기준을 10% 이상으로 하였으며, AML with BCR::ABL1은 WHO 개정안에서와 같은 이유로 blast 기준을 20% 이상으로 하였으나 CEBPA mutation 중 in-frame bZIP CEBPA mutation을 나타내는 경우에는 blast 기준을 10% 이상으로 정한 점에서 차이를 보인다.
4) ICC 개정안에서는 10-19% blast를 나타내는 MDS case를 MDS/AML로 진단하고 있는데, 이는 AML과 MDS의 진단적 연속체(diagnostic continuum) 및 임상적, 유전학적 이질성(heterogeneity)을 반영한다. MDS/AML은 다시 MDS/AML with mutated TP53, MDS/AML with myelodysplasia-related gene mutations, MDS/AML with myelodysplasia-related cytogenetic abnormalities, MDS/AML, NOS로 세분된다. 따라서 ICC 개정안에서 AML with mutated TP53, AML with myelodysplasia-related gene mutations, AML with myelodysplasia-related cytogenetic abnormalities, AML, NOS의 blast 기준은 20% 이상이다.
5) WHO 개정안에서 종전의 독립된 category였던 'AML with myelodysplasia-related changes (AML-MRC)‘는 'AML, myelodysplasia-related (AML-MR)'로 명칭이 변경되었으며, ‘Acute myeloid leukemia with defining genetic abnormalities’ 내로 편입되었다. Blast 기준은 20% 이상이다. MDS와 MDS/MPN에서 AML로 진행하는 경우는 생물학적 특징을 보다 폭넓게 통합하는 관점에서 AML-MR로 계속 정의하였으나, MPN에서 AML로 진행하는 경우는 MPN category에 남아있다. ICC 개정안에서도 ‘AML-MRC’는 독립된 category에서는 제외되었으며, ‘AML with myelodysplasia-related gene mutations’ 및 ‘AML with myelodysplasia-related cytogenetic abnormalities’의 형태로 남아있다.
6) ‘AML, myelodysplasia-related’를 규정하는 세포유전학적 이상이나 유전자 돌연변이는 두 분류에서 유사하나 약간의 차이가 있다. 11q deletion과 monosomy 13 or 13q deletion은 WHO 개정안에만 있고 TP53과 RUNX1 mutation은 ICC 개정안에만 있다. 즉, ICC 개정안에는 이전의 AML with mutated RUNX1이라는 provisional entity가 포함되어 있으나, WHO 개정안에서는 AML에서의 RUNX1 mutation을 충분한 specificity가 부족하다고 판정하여 독립적인 AML 아형에서 제외하였다. Table 3에서 두 개정안에서 차이가 있는 부분은 붉은색으로 표시하였다.
7) WHO 개정안에서 TP53이 들어간 진단명은 'MDS with biallelic TP53 inactivation'과 myeloid neoplasms associated with germline predisposition 중 'Germline TP53 P/LP variant (Li-Fraumeni syndrome)'뿐이며, AML에서는 TP53을 나타내는 군이 예후가 불량하다는 점은 인정하였으나 독립적인 질환군으로 분류하지는 않았다. 반면에 ICC 분류에서는 'myeloid neoplasms with mutated TP53'을 독립적인 질환군으로 분류하였고 여기에는 MDS with mutated TP53, MDS/AML with mutated TP53, AML with mutated TP53이 포함되었다. TP53 mutation은 현저하게 예후가 불량한 AML category를 구성하는데, de novo AML, MDS로부터 진행된 AML, 또는 therapy-related disease를 모두 포함한다. MDS with mutated TP53의 진단에는 multihit TP53 mutation이 필요하지만, AML and MDS/AML with mutated TP53의 진단에는 어떤 형태의 pathogenic TP53 mutation도 다 해당되며, VAF >10%면 된다.
8) 이전의 치료 및 선행하는 myeloid neoplasm (MDS or MDS/MPN), 또는 기저의 AML 소인 관련 germline genetic disorder의 중요성은 잘 알려져 있지만, 두 개정안 모두에서 이러한 연관성을 특정 질환군으로 보기보다는 진단적 수식 어구(diagnostic qualifier)로 표기하기로 하였고, 형태학적, 유전학적 특징에 따른 질환 분류를 최우선 순위로 두었다. 따라서 이전의 독립된 질환군으로서의 'therapy-related myeloid neoplasms'와 'AML with myelodysplasia-related changes'는 삭제되었다. ICC 개정안에서 항암화학요법 또는 방사선치료와 관련된 모든 myeloid neoplasm case는 진단명 뒤에 진단적 수식 어구로 'therapy-related'를 붙이며, 기존의 germline predisposition mutation 또는 syndrome도 진단 및 아형 뒤에 명시한다. WHO 개정안에서는 'therapy-related' 대신에 "myeloid neoplasms post cytotoxic therapy (MN-pCT)"와 같이 표기한다. MN-pCT 진단기준에 PARP1 억제제 사용 이력이 추가되었으며, methotrexate는 제외되었다. 'post cytotoxic therapy'와 마찬가지로 germline [gene] variant와 연관있는 경우에도 'associated with germline [gene] variant'를 myeloid neoplasm (MDS, MDS/MPN, AML) 진단명 뒤에 진단적 수식 어구로 붙인다(예: AML with KMT2A rearrangement post cytotoxic therapy or MDS with low blasts associated with germline RUNX1 variant).
Table 3. Classification of acute myeloid leukemia (AML)
8. Myeloid/lymphoid neoplasms with eosinophilia and tyrosine kinase gene fusions (MLN-TK or M/LN-eo with TK gene fusions)
1) WHO, ICC 개정안 모두에서 질환군 명칭이 'Myeloid/lymphoid neoplasms with eosinophilia and gene rearrangement'에서 'Myeloid/lymphoid neoplasms with eosinophilia and tyrosine kinase gene fusions'로 변경되었다. 단, 약어에서는 차이를 보이는데 WHO 개정안에서는 'MLN-TK'를, ICC 개정안에서는 'M/LN-eo with TK gene fusions'를 사용한다. 진단체계의 관점에서 볼 때 MLN-TK (or M/LN-eo with TK gene fusions)의 진단은 다른 골수계 및 림프계 종양 아형에 우선한다.
2) WHO 개정 4판(2016)에서 myeloid neoplasm with t(8;9)(p22;p24.1);PCM1-JAK2가 provisional entity로 새롭게 포함되었으나, PCM1 이외의 유전자와 fusion을 형성하는 JAK2 rearrangement가 관찰됨에 따라 'MLN-TK with JAK2 rearrangement'가 별개의 아형이 되었다. 또한 FLT3 rearrangement와 ETV6::ABL1 fusion도 아형으로 추가되었다. JAK2, FLT3, ETV6::ABL1가 추가된 것은 WHO, ICC 개정안에서 동일하나, 추가적으로 WHO 개정안에서는 'MLN-TK with other defined tyrosine kinase fusions'라는 항목으로 새로운 genetic framework이 추가되었다. 여기에는 ETV6::FGFR2 등이 포함된다.
9. 결론
앞에서 2022년에 발표된 WHO와 ICC의 골수계종양(Myeloid neoplasm) 분류 개정안을 비교해 보았다. 유사한 부분도 많으나, 상당한 차이점이 있어 두 그룹이 짧은 시간 안에 의견을 좁히기는 어려울 수도 있다. 두 가지 개정안이 공존하는 상황에서 실제 진단에 적용하는 데는 많은 어려움이 따를 것으로 보이며, 건강보험심사평가원 기준 등 제도적인 면도 고려해야 하는 상황이다. 차이가 있는 부분은 결과보고서에 두 가지 개정안의 내용을 병기하는 방안도 생각해 볼 수 있겠으나, 혼란을 최소화하기 위해서는 대한진단혈액학회, 대한혈액학회 등 관련 학술단체에서 이에 대해 자세히 논의하고 국내 consensus안을 마련하는 것이 필요하다고 생각된다.
참고문헌
- Khoury JD, Solary E, Abla O, Akkari Y, Alaggio R, Apperley JF, et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Myeloid and Histiocytic/Dendritic Neoplasms. Leukemia 2022;36:1703-19.
- Arber DA, Orazi A, Hasserjian RP, Borowitz MJ, Calvo KR, Kvasnicka HM, et al.
International Consensus Classification of Myeloid Neoplasms and Acute Leukemias
: integrating morphologic, clinical, and genomic data. Blood 2022;140:1200-28.
- Döhner H, Wei AH, Appelbaum FR, Craddock C, DiNardo CD, Dombret H, et al.
Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN. Blood 2022;140:1345-77.
- Falini B, Martelli MP. Comparison of the International Consensus and 5th WHO edition classifications of adult myelodysplastic syndromes and acute myeloid leukemia. Am J Hematol 2023 Jan 5. doi: 10.1002/ajh.26812. Epub ahead of print.
|
