|
CLSI-H62 를 통해 알아본 고감도 유세포 검사 검증 가이드라인 소개
(Introduction to the Validation of High Sensitivity Flow Cytometry Assay
in CLSI-H62 Guidelines)
분당서울대학교병원 김현지
1. Introduction
유세포 분석은 많은 수의 세포를 측정하여 특정 세포 집단을 높은 민감도로 식별할 수 있는 고감도 검사법이다. 검체 내 매우 적은 세포 분획도 분석이 가능하므로 임상적 적용 범위가 넓어 검사실에서 다방면으로 활용되고 있다. 현재 검사실에서는 CD34-양성 말초혈액 조혈모세포의 계수, 발작성야간혈색소뇨증의 진단 및 모니터링, 혈액암의 잔류 질환(minimal residual disease, MRD)의 모니터링 등에 유세포 검사를 적용하고 있다. 최근에는 검사실 내 활용뿐만 아니라, 세포 내 신호 전달과 같은 바이오마커 평가(예: 단백질 인산화) 및 세포 고갈 요법(예: 항-CD20 또는 항-CD19 치료 후 B 세포 고갈)의 효능 평가, 혈액 내 면역세포(예: follicular helper T-cells)에 대한 연구 등 다양한 분야에서 활용되고 있다. 유세포 분석의 활용 범위의 확대는 고감도 유세포 분석(high sensitive flow cytometry assay)을 필요로 한다. 고감도 유세포 분석은 전체 세포 집단의 0.1% 미만 빈도의 세포 분획도 측정이 가능한 분석법을 의미하며, 이를 위해서는 유세포 분석법 설계 시, 분석적/기능적 민감도에 대한 검증과정이 필수적이다. 하지만 유세포 검사는 측정이 복잡할 뿐만 아니라 데이터의 특성 및 다양한 질병 상태와 관련된 매질의 변화 등의 문제로 검증에 어려움이 있다. 유세포 검사의 수치 데이터는 표준물질(reference standard) 및 교정 곡선(calibration curve)을 통한 산출이 불가능하며, 세포 기반 측정 시 산출된 결과로, 반정량 데이터(semiquantitative/quasiquantitative data)에 해당된다. 반정량 데이터는 정량 데이터(quantitative data)와는 다르므로, 일반적인 정량 검사의 검증 방법을 유세포 검사의 검증 시 그대로 적용하기는 어렵다. 유세포 검사의 검증법에 대한 표준화된 지침은 없었으나, 최근 유세포 분석에 대한 Clinical & Laboratory Standards Institute (CLSI) 가이드라인이 발표되어, 이를 토대로 고감도 유세포 분석의 검증법과 검사실에서 시행 가능한 최소 검증 기준에 대해 함께 알아보고자 한다.
2. Validation plan for high sensitivity flow cytometry assay
1) Pre-validation stage: Considerations for designing high sensitivity flow cytometry assay panel
유세포 분석법 설계 단계부터 다양한 고려 사항으로 분석 유형(assay type), 데이터 종류, 사용 목적(intended use), 측정 장비와 검사자 수, 패널 디자인, 분석 전략 및 환자에 대한 위험도 등이 있으며, 이에 따라 검증법의 선택이 달라질 수 있다. 유세포 검사의 사용 목적은 다양하기 때문에 CLSI 가이드라인에서는 분석 유형과 사용 목적에 따른 검증법을 선택하도록 제시하고 있다. 다른 유세포 검사법과 달리 고감도 유세포 분석법은 설계단계에서부터 반드시 고려해야 할 사항이 있다(Table 1).
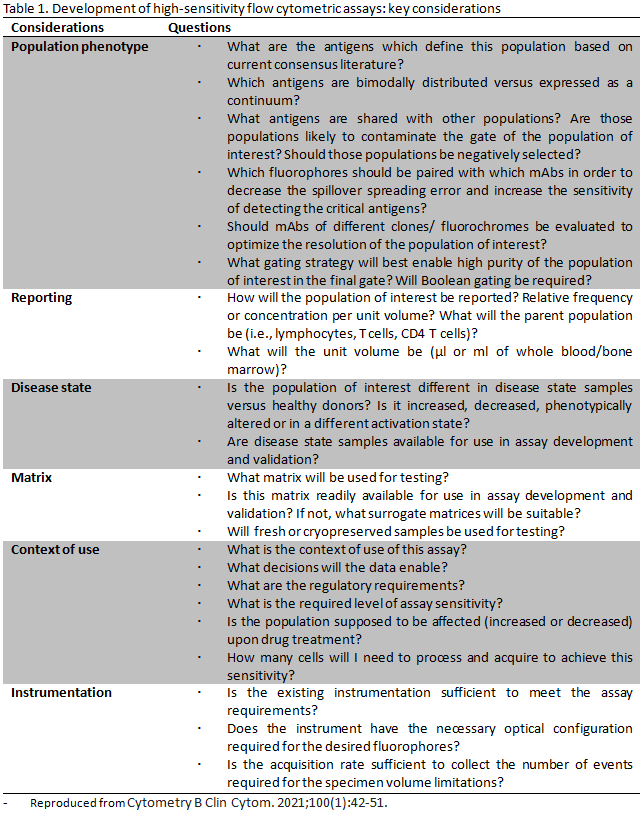
1-1) Assay risk considerations
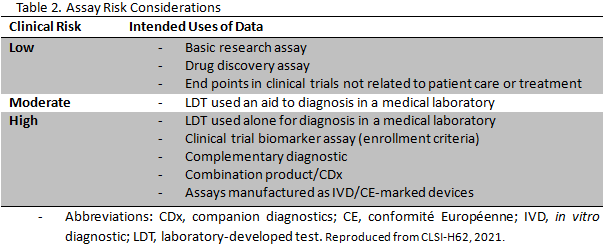
분석법의 위험도는 모든 유세포 검사의 설계 단계에서 고려되어야 한다. 분석의 의도된 사용과 오용이 환자 또는 피험자에게 어떻게 해를 입힐 수 있는지, 이러한 위험을 완화할 수 있는 능력을 고려하여 유세포 분석법에 대한 위험을 평가하게 된다. 위험도는 low, moderate, high 로 나뉘고(Table 2), 이에 따라 검증법 및 검증에 대한 요구 사항이 달라지게 된다.
1-2) Minimum number of events
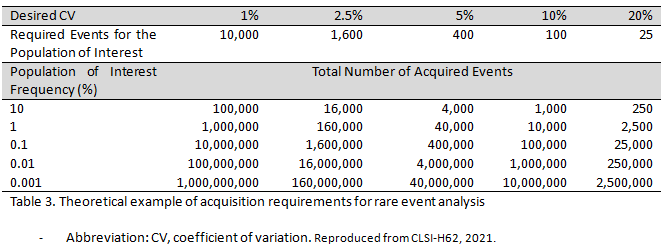
고감도 유세포 분석은 0.1% 미만의 매우 낮은 빈도로 존재하는 세포를 대상으로 하기 때문에, 분석법의 설계 시 게이팅(gating)된 부분에서 측정 가능한 충분한 수의 세포를 얻을 수 있는가가 중요하다. 여러 보고에서 유세포 분석의 측정 대상이 되는 세포 집단은 재현 가능성을 고려하였을 때, 최소 20~50개이상으로 존재해야 한다고 보고하였다. 측정 대상 세포 수 추정 및 원하는 수준의 민감도를 설정을 위해 포아송 통계(Poisson statistics)를 적용해볼 수 있다. 이 방법의 전제는 무작위로 분포된 모집단을 계수 시, 더 많은 이벤트가 획득될 수록 정밀도(precision)가 증가한다는 것이다. 샘플의 크기를 결정하기 위해, 변동 계수(coeffient of variation, CV)를 이용하여 아래의 식(Eq 1.)을 통해 분석 대상 세포의 수(r)를 추정할 수 있다.
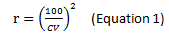
원하는 수준의 민감도에 따라 위 식을 통해 산출된 대상 세포의 수와 세포의 빈도를 이용하여, 유세포 검사 시 계수 해야 하는 전체 이벤트의 세포 수를 선정하는 것이 필요하다(Table 3).
1-3) Specimen considerations
고감도 유세포 분석 시, 낮은 빈도의 측정 대상 세포 분획이 잘 유지 될 수 있도록 검체의 안정성을 유지하는 것은 중요하다. 검체 채혈 후 분석까지의 시간에 따라 필요 시, 고정(fixation)을 하는 것이 필요할 수 있다. 고정 과정은 1차적으로는 세포의 구조적 안정을 유지해주며, 이외에도 세포 표면에 발현된 항원들의 내제화(internalization), 세포 분해, 항체 해리로 인한 신호 감소를 방지한다. 또한 염색 과정 시 세포의 활성화를 방지하고, 광산란을 막아준다. 고정 과정은 검체 안정성을 유지해줄 뿐만 아니라 핼액 매게 감염원(HIV, HBV 등)을 불활성화 시킴으로서 검사자의 안전도 도모할 수 있다. 따라서 검체 채혈 후 1시간 이내에 분석이 수행되지 않을 경우에는 검체 고정을 실시하는 것이 필요하다.
상용화 되어 사용가능 한 고정액으로는 aldehydes 계열과 alocohols 계열이 있다.
첫째로, Aldehyde 계열 고정액에는 formaldehyde, paraformaldehyde, methanol-free aldehyde, glutaraldehyde 가 있다. 이들은 단백질 내에 공유결합으로 교차 결합하여 안정성을 이루며, 특히 라이신 잔기에 잘 결합한다. 대부분의 검체에서 항원결정기(epitope)의 구조적 안정성을 유지해주는 장점이 있는 반면, formaldehyde의 경우 단백질에 과도하게 결합하여, 목표 항원결정기를 가려 검출이 안되는 경우를 야기하기도 한다.
둘째로, Alcohol 계열 고정액에는 ethonal, methanol이 있다. 이는 단백질 응고를 통해 고정하며, 동시에 지질을 용해하며 변성을 일으켜, 세포질 막에 구멍이 생기게 된다. 이들은 세포내 분석 시, 한 단계로 고정액 투과를 위해 사용되게 된다. 다만, 이들 고정액에 의한 변성과정은 항원결정기의 소실을 유발할 수도 있다.
검체의 고정과정은 필수적인 것은 아니나, 필요에 따라서는 적절한 고정과정을 실시하여 검체의 안정성을 보장하는 것이 필요하다.
2) Validation stage: Validation parameter and acceptance criteria for high sensitivity flow cytometry assay
정확도(accuracy), 직선성(linearity), 특이도(specificity)/선택도(selectivity), 민감도(sensitivity), 정밀도(precision), 안정성(stability) 및 참고구간(reference intervals) 등은 분석법 검증 시 평가되는 항목들이지만 모든 검증에서 반드시 이들을 포함할 필요는 없다. 고안된 분석법에 따라 및 검증 시 요구 사항은 다르므로, 적절한 분석항목을 선택하여 평가하는 것이 필요하다. 다만, 낮은 빈도의 세포 분획을 검출하는 고감도 분석법의 경우, 목표하는 세포의 분획이 최저정량한계(lower limit of quantification, LLoQ) 근처에 존재하게 되므로, LLoQ 설정이 중요하다. 또한 분석 특이성에 크게 영향을 받기 때문에, 분석 감도에 대한 고려와 함께 높은 특이도가 필요하다.
22-1) 민감도
-
Limit of blank (LOB) & limit of detection (LOD): 평가 샘플은 Fluorescence Minus One (FMO) 또는 Fluorescence Minus X (FMX)를 사용가능하며, 최소 10개 검체를 1번 이상 측정하고, 평균(mean), 표준편차(standard deviation, SD)를 계산하여, 아래의 식(Eq 2. & Eq 3.)을 통해 LOB, LOD를 산출할 수 있다.
LOB=Mean +1.645 SD (Equation 2)
LOD=Mean +3SD (Equation 3)
-
Lower limit of quantification (LLoQ): 낮은 레벨의 세포를 정확하게 측정할 수 있는 능력인 LLoQ는 고감도 유세포 분석 수행 전, 반드시 평가되어야 한다. LLoQ를 설정할 때 최소 3명 기증자의 검체 각각을 5가지 레벨로 희석하여 측정하게 된다. 희석 시, LLoQ가 5개 레벨 중간 정도에 있도록 하는 것이 가장 이상적이다. 모든 샘플은 단일 분석에서 세 번씩 측정하게 된다. LLoQ를 결정하는 방법은 모든 측정에 대해 평균, SD, %CV를 계산하게 된다. 측정 값에서 LOD 보다 낮은 값은 배제하고, 각각의 측정값이 LOD 보다 높으며, 이들의 평균값의 %CV가 35% 미만인 값으로 설정하게 된다.
2-2) 정밀도: 정밀도 검증에는 반복성(분석 내 정밀도, intra-assay precision), 재현성(분석 간 정밀도, inter-assay precision), 작업자 간 및 기기 간 변동이 포함되어야 한다. 고감도 분석의 경우 LLoQ에 가까운 낮은 수준의 샘플로 정밀도를 수행하는 것이 중요하다. 낮은 수준의 샘플에서 변동성이 높을 것이므로, 검증에는 최소 3~6개의 샘플을 포함하되 샘플 각각을 3번 반복 측정하는 것이 필요하다. 측정에 대해 평균, 표준편차, %CV를 산출하여, 고감도 분석의 경우 30~35% CV까지 허용 가능한 것으로 판단할 수 있다.
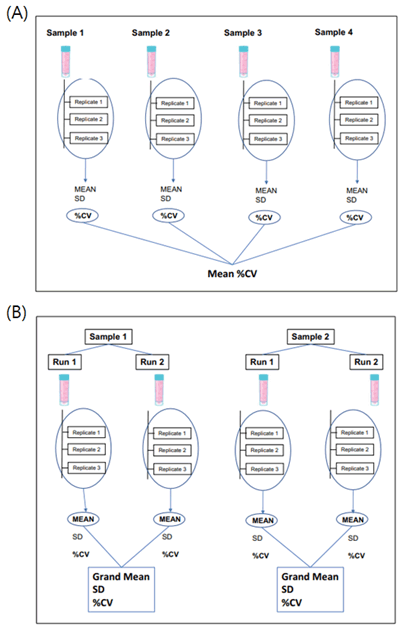
Figure 1. Repeatability (A) intra-assay precision. In this example, four samples are assayed in triplicate. Each sample is assayed in triplicate in the same analytical run. All testing is performed by one operator on one instrument. (B) inter-assay precision. In this example, two samples are assayed in triplicate in two analytical runs. All testing is performed by one operator on one instrument. Reproduced from Curr Protoc Cytom. 2019;87(1):e53.
2-3)안정성: 최소 3개 이상의 검체에 대해 시간의 흐름에 따라 측정을 반복한다. 각 시간의 시점 당 1번의 측정을 하게 된다. 분석은 검체 채취 후 바로 측정한 기저값에 대해 각 시간에서의 측정값 사이의 변화율(%change)을 계산하여 20% 미만의 변화율을 보인 시점까지 안정한 것으로 판단하게 된다.
2-4:잔효(Carry-over): 이는 분석 중에 평가하게 되며, 일반적으로 3개의 높은 수준의 샘플(H1, H2, H3)을 측정한 다음 3개의 낮은 수준의 샘플(L1, L2, L3)을 측정하여, 낮은 수준의 샘플 결과에 미치는 영향을 다음의 식(Eq 4.)을 통해 확인한다.
Carryover (%)=[(L1-L3)/(H3-L3)]×100 (Equation 4)
3. Conclusions
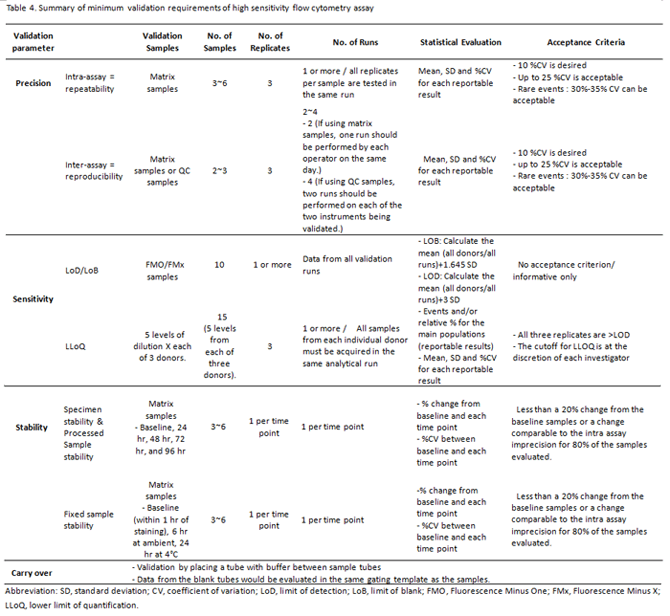
유세포 검사는 최근까지 표준화된 검증 지침이 없어, 각 검사실 마다 자체적인 방법으로 검증을 진행한 뒤 검사를 수행했다. 유세포 검사의 적용 범위가 확대되고, 고감도 유세포 검사의 사용이 증가되며, 표준화된 검증의 중요성이 강조되고 있다. 이러한 변화에 맞물려, 최근 CLSI-H62 지침이 발표된 것이라 생각한다. 세포기반 측정법인 유세포 검사는 검사의 특성상 검증에 어려움이 있을 수 있으나, 표준화된 지침이 마련된다면 각 검사실마다 표준화된 검증이 가능할 것이라 생각한다. 특히, 측정 대상 세포가 LLoQ 근처의 수치를 보이는 고감도 분석의 경우, 분석적/기능적 민감도가 평가되기 전까지는 결과에 대해 신뢰하기 어려워 환자에게 그대로 적용하는 것은 위험할 수 있다. 고감도 분석 시, 필요한 검증 항목 각각에 대해 CLSI-H62 와 다른 문헌을 토대로 정리(Table 4)한 본 내용이 국내 검사실의 표준화된 검증 지침 마련에 도움이 되길 기대해본다.
4. 참고 자료
- Guideline, CLSI. "H62: Validation of Assays Performed by Flow Cytometry; Ed1” (2021)."
- Sommer, Ulrike, et al. "High‐sensitivity flow cytometric assays: considerations for design control and analytical validation for identification of rare events." Cytometry Part B: Clinical Cytometry 100.1 (2021): 42-51.
- Selliah, Nithianandan, et al. "Flow cytometry method validation protocols." Current Protocols in Cytometry 87.1 (2019): e53.
|
