|
Pathophysiology, diagnosis and treatment of aplastic anemia
차충환(울산의대)
1. 병태생리(pathophysiology) - 후천재생불량빈혈에서 골수부전의 유전학
텔로미어(telomere)는 염색체의 끝분절로서 DNA excision enzyme으로부터 보호하는 역할을 하며 세포분열에 의해 생리적으로 짧아지는데, telomerase reverse transcriptase (TERT), telomerase RNA component (TERC), dyskerin (DKC1)로 구성되는 텔로머레이스(telomerase)에 의해 보상된다. 텔로머레이스는 배아조직과 복제요구가 있는 성인세포(조혈모세포, 림프구)에서 활성화된다. 텔로머레이스를 구성하는 유전자에 돌연변이가 발생하면 텔로미어 손실이 가속화된다. 텔로미어가 매우 짧아지면 세포자멸사가 일어나 노화된 세포로부터 기관을 보호하는 기전이 일어나는데, DNA 손상에 대한 반응이 저해되는 경우에는 매우 짧은 텔로미어를 가지는 세포가 증식하고 염색체는 불안정하거나 홀배수체(aneuploidy), nonreciprocal translocation, 악성전환하기 쉽게 된다.
TERC 돌연변이는 선천재생불량빈혈의 원인 중 하나인 dyskeratosis congenita 환자에서 발견되었으나, 이후 후천재생불량빈혈 환자들에서도 발견되었다. TERT 및 TERC 돌연변이가 있는 환자들은 대개 dyskeratosis congenita의 전형적인 피부소견을 보이지 않으며, 많은 환자들이 가족력을 가지고 있지 않기 때문에 모든 골수부전 환자에서 텔로미어 길이 측정이 필요할 수 있다. 골수기능부전, 특발폐섬유증 또는 간경화의 과거력 또는 가족력이 있는 사람은 telomeropathy가 있음을 시사하며 텔로미어 길이의 측정이 필요하다. 텔로미어 길이는 flow-FISH 또는 정량 PCR (백혈구, 림프구 또는 과립구의 텔로미어 DNA)로 측정되어 결과는 환자의 나이로 보정된다. 비정상적으로 텔로미어 길이가 짧아져 있으면 telomeropathy로 진단할 수 있다.
후천재생불량빈혈 환자들의 소수에서 텔로미어 길이가 비정상적으로 짧아져 있고 텔로머레이스 유전자(TERC 또는 TERT)에 돌연변이를 가지고 있는 경우도 있는 것으로 보고되었다. TERC 또는 TERT 돌연변이는 골수부전의 유전결정인자는 아니며 위험인자로 간주되고 있다. 이들 돌연변이가 있는 환자에서 이식 성적에 대한 체계적인 자료는 없으나 가족 내에서 동일한 돌연변이가 있는 사람은 공여자로 선택하지 않도록 하고 있다. 성호르몬은 TERT 유전자를 상향조절함으로써 텔로머레이스 활성을 증가시키는데, 이들 돌연변이가 있는 환자들에서 안드로겐 요법으로 혈액학적 호전이 보고되었다. 진단시 백혈구의 텔로미어 길이가 짧아져 있으면 재발과 clonal evolution의 위험이 증가하는 것으로 보고되었다.
2. 진단(diagnosis)
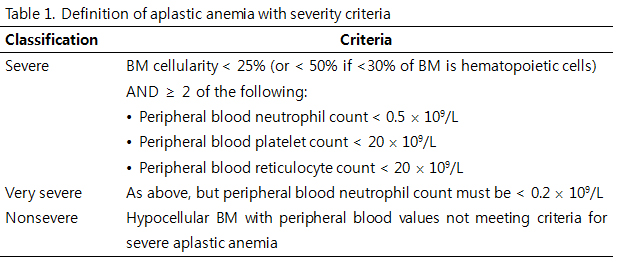
재생불량빈혈은 말초혈액의 세포감소증과 골수 세포충실도 감소의 소견으로 진단되며, 중증도에 따라 흔히 다음과 같이 분류한다(Table 1).
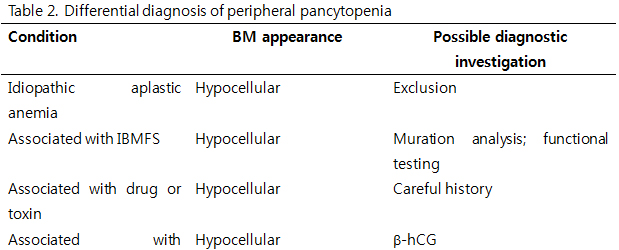
재생불량빈혈의 진단은 골수부전의 원인이 되는 다른 질환들을 배제함으로써 이루어진다(Table 2). 현재 다양한 검사들이 있지만, 문진과 진찰이 필수적이다. 문진을 통해 골수부전과 연관된 약물 또는 독소에 대한 노출 여부를 확인한다. 진찰로 질병특유의 소견을 가지는 것으로 여겨졌던 다른 원인질환들을 완전히 배제하는 데에는 한계가 있다. 선천재생불량빈혈(inherited BM failure syndromes, IBMFS)에 대한 유전자검사가 진단에 도움이 되나, 아직 모든 유전자변이가 밝혀져 있지 않으므로 불완전한 정보를 제공한다.

3. 치료(management)
증증재생불량빈혈(severe aplastic anemia)은 치료하지 않으면 치명적이기 때문에 일단 진단이 되면 치료가 지연되어서는 안된다. 조혈모세포이식(HSCT)과 면역억제치료(immunosuppressive therapy, IST), 지지요법(supportive care)이 재생불량빈혈의 주된 치료법이다.
1) 면역억제치료(immunosuppressive therapy, IST)
HLA가 일치하는 형제간 공여자가 없는 경우 최적요법(treatment of choice)으로서 대다수의 환자가 받게 되는 치료법이다. Horse antithymocyte globulin (ATG)과 cyclosporine을 사용하는 것이 표준이다. 약 2/3의 환자가 치료에 반응하지만 그 중 30%~40%는 재발(추가적인 면역억제치료가 필요한 경우로 정의)하거나 혈액수치 유지에 cyclosporine 의존성을 보이게 된다. Cyclosporine을 장기간(6개월 투여 후 서서히 감량하여 총 2년)에 걸쳐 사용하는 것이 재발을 지연시키는 것으로 보고되었다. 재발 외에 면역억제치료의 또 다른 부작용은 이차클론혈액질환(PNH, 골수형성이상증후군, 백혈병)이 발생하는 것(clonal evolution)으로 새로운 염색체 이상이 동반된다. Monosomy 7이 가장 흔한 염색체 이상이며 혈액수치의 악화, 면역억제치료에 무반응, MDS 및 백혈병으로 진행과 연관된다. 다른 염색체 이상들(del13q, trisomy 8, del20q)도 나타날 수 있는데 골수혈성이상증후군으로 진행과의 연관성은 확실하지 않으며, 일시적인 경우도 있으며 골수의 형성이상소견 및 혈액수치의 악화와 연관되지 않는다. Danazol, mycophenolate mofetil, sirolimus, 또는 hematopoietic growth factors를 추가하는 방법도 있으나 기존 요법보다 유의하게 반응이 향상되거나 재발율을 낮추지 못하였다. Cyclosporine 대신에 또는 cyclosporine에 추가하여 tacrolimus, cyclophosphamide나 alemtuzumab을 사용하는 방법에 대한 연구들이 진행 중이다.
2) 조혈모세포이식(hematopoietic stem cell transplantation, HSCT)
HLA가 일치하는 형제간 이식(allogeneic HLA-matched sibling donor HSCT)
현재까지 유일하게 완치가 가능한 치료법이다. HLA가 일치하는 형제간 공여자가 있는 중증(severe)재생불량빈혈 또는 초증증(very severe)재생불량빈혈 환자에게 추천되는 일차치료로서 대개는 40세까지의 환자에게 추천된다. 급성/만성 이식편대숙주병(graft-versus-host disease, GVHD) 없이 성공적인 생착이 이루어지도록 하는 것이 재생불량빈혈에서 이식의 주된 목표이다.
조혈모세포원으로 골수를 사용하고, 이식 전처치는 cyclophosphamide와 ATG로 시행하고, GVHD 예방은 cyclosporine과 methotrexate로 하는 것이 HLA가 일치하는 형제간 이식의 최적표준(gold standard)이며, 생착율 95%, overall survival이 약 90%에 달한다. 조혈모세포원으로 말초조혈모세포를 사용하는 것은 만성GVHD 빈도가 증가하여 치료관련 사망의 위험이 더 높다. 거부반응을 막기 위하여 방사선조사 등을 포함한 이식 전처치를 시행하는 것은 이식 관련 장기적 이환율과 사망률을 높이는 것으로 보고되었다. 거부반응은 이식을 조기에 받는 환자에서는 현재 흔하지 않은데, 수혈을 많이 받지 않고, 더 적은 수의 공여자(성분채혈 혈소판)로부터 더 적은 면역원을 가진 혈액제제(백혈구 제거 적혈구)를 사용하기 때문인 것으로 여겨진다.
최근 이식의 모든 분야의 발전으로 이식의 성적이 매우 향상되어 현재는 40~50세의 환자에게도 HLA가 일치하는 형제간 공여자가 있는 경우 대부분 이식을 추천하는데, 나이가 많으면 GVHD의 발생위험이 높으므로 이식관련 합병증이 증가하고 생존율이 나쁘기 때문에 이 연령군에서는 면역억제치료와 이식의 장단점들을 서로 고려하여 치료법을 선택해야 한다.
대체공여자 이식(alternative donor HSCT)
HLA가 일치하는 형제간 공여자를 가질 확률은 25~30% 정도이다. HLA가 일치하는 형제간 공여자가 없는 환자가 면역억제치료에 실패한 경우 대체 공여자 이식이 고려될 수 있다. 대체 공여자(alternative donor)로는 HLA가 일치/불일치하는 비혈연 공여자(unrelated donor, URD) 또는 HLA가 불일치하는 혈연 공여자가 있으며, 고해상도로 HLA가 일치하는 비혈연 공여자가 가장 좋은 선택이 될 수 있다. 생존율은 30%~40%에서 HLA 형별검사법의 발전과 이식 전처치 요법의 변화로 향상되어 현재 70% 정도이다. 이식 전처치는 fludarabine, cyclophosphamide, ATG를 가장 많이 사용하며, 성인의 경우 저용량(2 Gy) 전신방사선조사를 추가한다. GVHD 예방은 cyclosporine과 methotrexate로 시행한다. 조혈모세포원으로 말초조혈모세포를 사용하는 경우 만성GVHD 빈도가 더 높고 생존율이 낮은 것으로 보고되어 골수가 더 선호된다. 이식 후 성적에 가장 관련 있는 예측인자는 진단 후 이식까지의 기간으로, 2년이 넘는 경우 사망의 상대위험도가 4.4로 보고되었다.
3) 지지요법(supportive care)
재생불량빈혈의 모든 단계에서 지지요법이 이루어져야 한다. 감염, 출혈, 치료약제의 독성에 대한 기대치료(expectant management), 정신과적 지지와 같은 문제들에 대한 세심한 주의가 필요하다. 이식 또는 ATG 치료가 시작되면 ATG에 대한 반응이 3개월까지도 지연될 수 있으므로 이 시기에 지지요법이 필수적이다.
수혈요법
혈소판수 < 10x109/L일 때 출혈을 예방하기 위하여, 발열 또는 출혈이 있는 경우 혈소판수 < 20x109/L인 경우 혈소판 수혈을 시행한다. 백혈구제거 혈액제제를 수혈하더라도 HLA 동종면역이 발생할 수 있다. 혈소판불응성은 HLA 적합 혈소판 수혈이 도움이 된다. 이식 예정인 환자는 가족의 혈액 수혈시 minor HLA 항원에 감작이 일어나 이식 후 거부반응의 위험이 증가하므로 피해야 한다. 방사선조사 혈액제제는 모든 이식환자 이외에도, ATG 치료 후 수혈관련 GVHD의 위험을 감소시키고 HLA 및 비HLA 항원에 감작되는 것을 감소시키기 위한 목적으로 사용되어야 한다. 한 EBMT 조사에서는 대부분의 기관이 ATG 치료 후 방사선조사 혈액을 사용하는 것으로 답하였으나 사용기간은 일치하지 않았다. 철과다 상태가 이식 관련 사망에 기여하기 때문에 이식예정자에서 혈청 페리틴 > 1,000 μg/L이면 철킬레이트화(iron chelation)를 시행하며 desferrioxamine (정맥주사/피하주사) 또는 deferasirox (경구)를 사용한다.
감염
감염은 중증재생불량빈혈의 주된 사망원인으로 호중구감소증이 지속되면 진균 감염과 세균성패혈증의 빈도가 높다. 발열을 동반하는 호중구감소증의 경우 광범위 주사용 항생제 및 항진균제를 사용해야 한다.
4. 참고문헌
Young NS, Calado RT, Scheinberg P. Current concepts in the pathophysiology and treatment of aplastic anemia. Blood. 2006;108:2509-19.
Guinan EC. Diagnosis and management of aplastic anemia. Hematology Am Soc Hematol Educ Program. 2011;2011:76-81.
Scheinberg P. Aplastic anemia: therapeutic updates in immunosuppression and transplantation. Hematology Am Soc Hematol Educ Program. 2012;2012:292-300.
Young NS. Current concepts in the pathophysiology and treatment of aplastic anemia. Hematology Am Soc Hematol Educ Program. 2013;2013:76-81.
Socie G. Allogeneic BM transplantation for the treatment of aplastic anemia: current results and expanding donor possibilities. Hematology Am Soc Hematol Educ Program. 2013;2013:82-6.
Marsh JC and Kulasekararaj AG. Management of the refractory aplastic anemia patient: what are the options? Hematology Am Soc Hematol Educ Program. 2013;2013:87-94.
|
