|
고도B세포림프종(High-grade B-cell lymphoma)
원자력병원 진단검사의학과 장윤환
1.정의
고도B세포림프종[high grade B-cell lymphoma (HGBL)]은 임상적 악성도가 높은 성숙B세포림프종군을 의미하며, 달리 분류되지 않는 광범위큰B세포림프종[diffuse large B-cell lymphoma, not otherwise specified (DLBCL, NOS)] 및 버킷림프종(Burkitt lymphoma, BL)과는 생물학적, 임상적으로 다른 질병군이다.
2016년 세계보건기구(World Health Organization, WHO) 분류 개정에서 HGBL은 두 가지 범주로 구분할 수 있는데, 한 가지는 "MYC and BCL2 and/or BCL6의 재배열을 보이는 고도B세포림프종(HGBL with MYC and BCL2 and/or BCL6 rearrangements)"이고, 다른 한 가지는 “달리 분류되지 않는 고도B세포림프종(HGBL, NOS)”이다(Fig. 1).
첫 번째 범주인 HGBL with MYC and BCL2 and/or BCL6 rearrangements는 MYC (8q24) 재배열과 BCL2 (18q21) and/or BCL6 (3q27)의 재배열이 함께 나타나는 모든 B세포 림프종을 포함한다. 즉, 소위 "이중유전자이상” 림프종(“double hit” lymphoma) 또는 “삼중유전자이상” 림프종(“triple hit” lymphoma)을 의미한다. 단, 여기에서 일부 드문 소포림프종(follicular lymphoma)과 B림프모구백혈병/림프종(B-lymphoblastic leukemia/lymphoma)은 제외된다. 형태학적으로 이러한 증례들은 전형적으로는 DLBCL, NOS와 유사하거나 BL과 DLBCL의 양쪽 형태를 다 보일 수도 있다. 지난 2008년 WHO 분류에서는 “DLBCL과 BL의 중간 형태를 보이는 미분류B세포림프종(B-cell lymphoma, unclassifiable with features intermediate between DLBCL and BL)”이라고 명명되었다. 드물게 모세포와 유사한 형태(blastoid)이기도 하며, 형태학적으로 림프모구림프종(lymphoblastic lymphoma)이나 외투세포림프종(mantle cell lymphoma)의 모세포 모양 변이형(blastoid variant)과 유사한 형태를 보이기도 한다.
두 번째 범주인 HGBL, NOS는 DLBCL과 BL의 중간 형태를 보이거나 모세포와 유사한 형태로 보이는 증례들을 포함하는데, 정의상 상기에 정의된 이중 또는 삼중유전자이상을 나타내지 않아야 한다. 이러한 범주는 DLBCL 형태를 가진 증례는 배제해야 하며, 고증식분획(high proliferative fraction)이 존재하는 경우에도 그러하다.
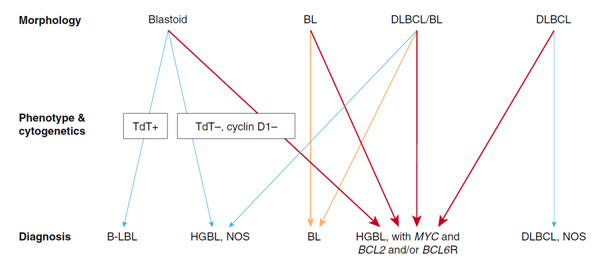
Fig. 1. Diagnostic approach to HGBLs (Blood 2016;127:2375?90).
2. DLBCL과 double hit lymphoma
DLBCL은 가장 흔한 B세포 비호지킨림프종으로, 국내 단일기관 연구에서는 전체 림프구계 종양의 30.5%를 차지한다는 보고가 있었으며, 미국에서는 B세포 림프종의 30-40%를 차지한다. 분자 및 유전자 수준에서 DLBCL은 이질적인 질환이다. 유전자 발현 프로파일링(gene expression profiling, GEP) 연구에 근거하여 기원 세포(cell of origin, COO)에 따라 배중심 B세포 (germinal center B-cell, GCB) 아형 및 활성화 B세포 (activated B-cell, ABC) 아형의 두 가지 군으로 분류할 수 있다. 약 15-20%는 이러한 두 가지 범주에 잘 맞지 않기 때문에 분자유전학적으로 분류할 수 없다. 다양한 면역조직화학 방법도 COO에 따라 DLBCL을 분류하는 데 사용된다.
가장 널리 사용되는 알고리즘은 Hans등이 제창한 내용에 근거한 것으로, 3가지의 세포 단백질(CD10, BCL6, MUM1/IRF4)의 발현을 평가하는 것이다. 이 알고리즘을 사용하면 DLBCL은 GCB 또는 비GCB로 분류된다. 일반적으로 GCB 아형 DLBCL은 어떻게 정의되어 있는지에 상관없이 표준 RCHOP 화학요법으로 치료받은 경우에 양호한 결과를 나타낸다.
COO 이외에, 최근 유전학 및 단백질체학 연구를 통해 MYC 및 BCL2 유전자 전좌와 단백질 동시 발현에 대한 예후 예측 역할이 확인되었다. 형광제자리부합법(fluorescence in situ hybridization, FISH)을 이용한 이전 연구에서는 DLBCL의 7-10%가 MYC, BCL2 and/or BCL6 전좌를 나타내며, "이중유전자이상” 림프종(“double hit” lymphoma, DHL) 또는 “삼중유전자이상” 림프종(“triple hit” lymphoma)이라고 명명했다. 2016년 WHO의 림프종 분류 개정에서 이러한 범주는 "MYC and BCL2 and/or BCL6의 재배열을 보이는 고도B세포림프종(HGBL with rearrangements of MYC and BCL2 and/or BCL6)"으로 분류되고 있다.
3. HGBL with MYC and BCL2 and/or BCL6 rearrangements
MYC은 세포주기, DNA 손상 복구, 대사, 단백질 합성 및 스트레스 반응에 관여하는 몇 가지 표적 유전자의 발현을 조절하는 전사 인자이다. 인간에서 MYC은 8번 염색체 (8q24)에 위치하고, 조절 영역 또는 촉진자(promoter) 영역을 포함하는 돌연변이, 염색체 전좌 및 복제수(copy number) 증가에 의해 활성화될 수 있다. 정상 세포에서는 MYC은 TP53 경로를 활성화하고 세포자멸사(apoptosis)를 일으키지만, MYC 전좌를 가진 세포는 세포자멸사를 피할 수 있도록 해주는 TP53 불활성화 돌연변이를 가지는 경우도 많다. MYC 전좌를 나타내는 DLBCL은 BCL2 and/or BCL6 전좌를 동반하기도 하며, 그러한 경우 임상적 악성도가 높다. 대부분의 보고에서 MYC 전좌는 DLBCL의 약 10% (범위 4-14%)에서 발견되고 주로 GCB 아형에서 관찰된다.
BCL2는 일반적으로 항세포자멸사 기능을 수행한다. t (14; 18)의 경우에 BCL2 전사의 조절이상으로 인하여 이환된 B세포는 생존에 유리하게 된다. BCL2 전좌는 새로 발생한(de novo) DLBCL의 20-30%에서 발견되며 대부분의 경우는 GCB 아형에서 관찰된다.
BCL6는 정상 성숙 배중심 B세포에서 발현되며 전사 억제 인자로서 작용한다. BCL6가 과발현되면 DNA 손상에 대한 세포자멸사를 막는다. 그 작용은 p53과 매우 밀접하게 연관되어 있다.
Genetic DHL은 주로 DLBCL의 GCB 아형에서 관찰되는 반면, MYC 및 BCL2 단백질의 이중 발현은 ABC 및 GCB 아형 모두에서 관찰된다. DHL은 이중단백질발현이 있는 경우의 작은 부분을 차지한다(Fig. 2). 이중단백질발현 DLBCL의 발병률은 19-34%로 추산되며, MYC만 단독으로 발현하거나 단백질을 발현하지 않는 환자보다 나쁜 예후와 관련이 있다. 이중단백질발현림프종의 임상 경과는 RCHOP으로 치료할 때 DLBCL NOS와 DHL의 중간 정도의 결과를 나타낸다. ABC 아형 DLBCL에서 나타나는 불량한 결과는 MYC/BCL2 단백질 과발현과 그로 인해 발생한 체내 작용의 결과라는 설이 제기되었다.
DHL의 정의는 수년 동안 진화해 왔다. 초기에 이 질병단위(entity)는 새로 발생한 DLBCL로 제한되었다. 나중에는 전환된 소포림프종(transformed follicular lymphoma) 및 기타 희귀 질병단위의 사례가 포함되었다. DHL은 이제 MYC과 BCL2 and/or BCL6의 재배열을 보이는 “고도B세포림프종 (HGBL)"으로 인정되고 있다. 이중유전자이상을 가진 DLBCL 환자의 대다수는 GCB 아형에서 관찰된다. BCL2 전좌는 초기 현상으로서 배중심 종양에서만 발생한다. MYC 전좌는 2차 현상이며 BCL2 또는 BCL6 전좌와 연관있는 경우가 많다.
DHL에서 보이는 악성 임상 경과와 치료에 대한 불량한 반응과는 대조적으로 GCB 아형은 전형적으로 양호한 예후를 나타내며, 이는 예후에
대한 분자유전학적 분류와 적절한 치료 선택의 중요성을 분명하게 보여준다. MYC 및 BCL6 전좌를 나타내는
림프종 (MYC/BCL6 DHL)은 MYC/BCL2 전좌가 있는 DHL과 비교하여 생물학적으로 다른 질병인 것으로 보인다.
MYC/BCL6 DHL은 훨씬 드물고 더욱 면역모세포 양상을 띠는 ABC 아형이며, 세포유전학적 복잡성도 더 적다. 이러한 종양은 임상적으로
BCL2 재배열 종양과는 완전히 다르다. 치료적 의미에서 한 가지 차이점은 MYC/BCL2 DHL은 종종 TP53 돌연변이를
나타내지만 MYC/BCL6 DHL은 그렇지 않다는 점이다. 삼중유전자이상 림프종은 MYC, BCL2 및
BCL6에서 염색체 변화가 있는 B세포 림프종으로 정의되며 DHL과 비슷한 예후를 보인다.
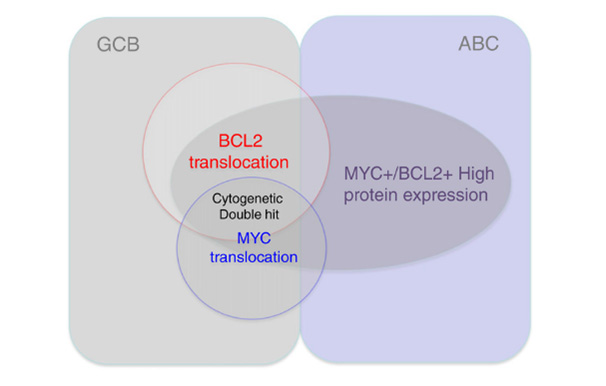
Fig. 2. Relationship among cell of origin in diffuse large
B-cell lymphoma in terms of MYC/ BCL2 protein expression and genetic translocations
(Blood Rev 2017;31:37-42).
4. Double protein expressing (DE) lymphoma와 double hit lymphoma
두 가지 후향적 연구가 이중단백질발현림프종(DE)과 이중유전자이상림프종(DHL)의 특성을 비교했다. 첫 연구에서는 193명 중 54명의 환자가
면역조직화학염색에 의한 DE 림프종(MYC>40%, BCL2>70%)이었고, 193명 중 11명은 FISH(MYC/BCL2)에 의한 "이중유전자이상"이었다.
나타나는 특성은 다르지 않았지만 DHL의 91%는 GCB였고 37%는 DE 림프종이었다. DE 환자는 국제예후 지표(international
prognostic index, IPI) 또는 COO의 영향없이 독립적으로 DLBCL NOS보다 RCHOP 치료 후 더 낮은 완전관해율[complete
response (CR) rate]을 나타내었고(P=0.004), 전체생존기간(overall survival, OS)과 (P<0.001) 무진행생존기간(progression free survival, PFS)은 더 짧았다(P<0.001). Median OS는 DHL의
경우 13개월이었고 비전좌(non-translocated) 환자의 경우 95개월이었다. DE와 DHL은 극히 예후가 불량하며 "이중유전자이상"의
생물학적 특성을 가지는 DLBCL을 식별하는 데 있어 면역조직화학염색으로 충분하다는 의견이 있다.
두 번째 연구에서는 307명의 환자 중 21%가 DE (>40% MYC, >50% BCL2)였고 10 명의 환자는 FISH 결과에서 "이중유전자이상"이었다.
양쪽 모두 진행된 병기와 림프절외 질환과 관련이 있었지만, DHL 환자는 양호하지 않은 수행도(performance status, PS),
높은 LDH 및 높은 IPI를 나타내는 경향이 더 많았다. GCB 면역표현형은 DHL에서 더 많이 보였으나 DE 림프종은 ABC 표현형이 더
많았다. 더 낮은 OS와 PFS는 면역조직화학염색에서 MYC/BCL2가 함께 발현될 때 나타나고 MYC 단독 발현 시에는 나타나지 않았다.
RCHOP로 치료한 DLBCL (N=893)의 분석에서, DE (34 %) (MYC>40 %, BCL2>70 %) 림프종은 ABC 아형이었고
진행 단계가 높고, Ki67이 높았으며, IPI가 높았다. DE 림프종은 단백질을 발현하지 않는 DLBCL에 비해 반응 속도(response
rate, RR), PFS 및 OS가 낮았다. ABC와 GCB 아형에 걸친 유전자 발현 프로파일링은 GCB와 비교할 때 ABC DLBCL군에서
BCL2 (P<0.0001)와 MYC 발현 빈도(P=0.0009)가 유의하게 높았다. DE 사례를 제외하고
ABC 아형은 더 이상 불량한 결과와 관련이 없다. 이 데이터는 MYC/BCL2 동시 발현이 RCHOP 치료를 받는 DLBCL 환자에서 COO보다
우수한 예후 예측 인자임을 시사한다.
대부분의 후향적 연구에서 DHL과 DE 림프종은 RCHOP와 같은 전통적인 치료법으로 치료할 때 예후가 불량하다는 것을 시사했다. 그러나 대규모
무작위 연구에서 MYC와 BCL2의 역할에 대한 최근의 분석은 DHL이 예후가 열등하지 않을 수도 있음을 시사했다. 유사하게, DA-R-EPOCH를
이용한 NCI의 소규모 전향적 연구는 이러한 환자의 대다수가 공고요법적인 자가조혈모세포이식을 필요로 하지 않고 치료될 수 있다고 제안했다.
DHL 및 DE 림프종 환자의 전향적 연구를 수행하여 이들 환자의 진정한 예후를 판단해야 할 필요가 있다.
MYC, BCL2 및 BCL6 단백질 발현에 대한 면역조직화학염색의 단일 양성 기준(cutoff)이 설정되어 있지 않으면 연구 간에 비교가
복잡해지고 결과를 도출하기가 어렵게 된다. MYC≥40%, BCL2≥50% 및 BCL6≥30%의 표준화된 양성 기준이 설정된 바 있다.
참고문헌
- Swerdlow SH, Campo E, Pileri SA, Harris NL, Stein H, Siebert R, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood 2016;127:2375-90.
- Rosenthal A, Younes A. High grade B-cell lymphoma with rearrangements of
MYC and BCL2 and/or BCL6: Double hit and triple hit lymphomas and double expressing
lymphoma. Blood Rev 2017;31:37-42.
- Yoon SO, Suh C, Lee DH, Chi HS, Park CJ, Jang SS, et al. Distribution of lymphoid neoplasms in the Republic of Korea: analysis of 5318 cases according to the World Health Organization classification. Am J Hematol 2010;85:760-4.
- Hans CP, Weisenburger DD, Greiner TC, Gascoyne RD, Delabie J, Ott G, et al. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray. Blood 2004;103:275-82.
- Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th ed. Lyon: IARC, 2017:335-41.
|
