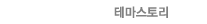|

|
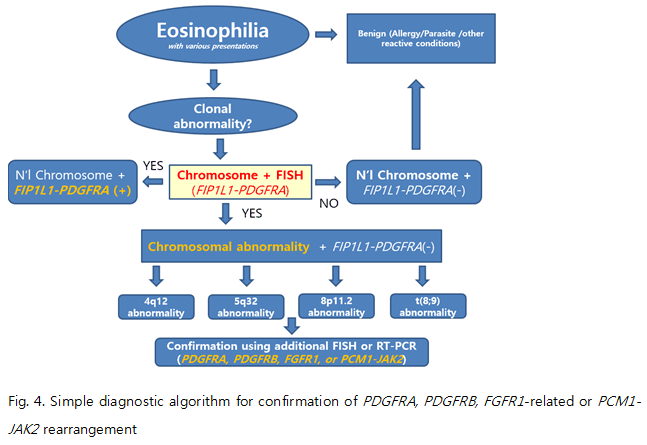
클론성 호산구증가증의 2016 WHO 분류 - PDGFRA, PDGFRB, FGFR1 유전자재배열 및 PCM1-JAK2 중심으로 경희대학교 의과대학 진단검사의학과 박태성 목적: 2016 WHO 분류에 따른 myeloid/lymphoid neoplasms에서의 클론성 호산구증가증과 관련된 유전자재배열(myeloid/lymphoid neoplasms associated with eosinophilia and specific gene rearrangements)에 대한 전반적인 이해와 최신 지견 습득을 목적으로 한다. Introduction 호산구성 질환(eosinophilic disorders)의 분류와 관련된 첫번째 주요한 업적(first landmark)은 1968년도에 Hardy와 Anderson이 ‘hypereosinophlic syndrome(HES)’ 라는 용어를 사용한 일이며, 그로부터 7년 후에 Chusid 등이 HES의 보다 구체적인 진단기준을 제시하였다(6개월 이상 지속되는 1,500/uL 이상의 호산구증가증; 기생충, 알러지 혹은 다른 알려진 호산구증가증의 원인이 없는 경우; 말단 기관 손상의 증상과 징후 등). 1990년대 이전에는 호산구증가증에 대한 구체적 원인이 없는 경우 idiopathic HES로 단순히 간주하였으나, 1990년대 이후로 분자진단기법 및 치료제의 획기적인 발전에 힘입어 이전에 보고되지 않았던 eosinophilia와 연관된 recurrent genetic abnormalities의 규명 및 클론성 호산구증가증에 대한 imatinib mesylate와 같은 target therapeutic agent의 성공적인 임상 적용이 가능하게 되었다. 마침내, 2008년 WHO 분류에서는 이러한 클론성 호산구증가증을 myeloproliferative neoplasms(MPN)에 포함된 HES, chronic eosinophilic leukemia(CEL, not otherwise categorized) 등으로부터 분리된 독립적인 카테고리인 ‘myeloid/lymphoid neoplasms associated with eosinophilia and specific gene rearrangements’로 분류하게 되었다. 이미 잘 알려진 바와 같이 2008 WHO 분류에서 클론성 호산구증가증과 연관된 3가지 주요 유전자들은 PDGFRA, PDGFRB 및 FGFR1이며, 이들은 드물게 검출되나 다양한 파트너 유전자들과 특정한 유전자재배열을 형성하는 것으로 알려져 있다. 호산구증가증과 연관된 분자유전학적 이상 (2016 WHO 분류) 2016 WHO 분류에 근거한 eosinophilia와 연관된 분자유전학적인 이상은 기존의 2008 WHO 분류에서의 주요 유전적 이상(PDGFRA, PDGFRB, FGFR1 관련 유전자재배열) 이외에 PCM1-JAK2 유전자재배열이 추가되었다. 기존의 3가지 유전자 및 유전자재배열들의 특성과 더불어서 새롭게 추가된 PCM1-JAK2 유전자재배열에 대해 간략히 리뷰해 보고자 한다(Table 1). (단, PDGFRA, PDGFRB 및 FGFR1 유전자재배열 관련해서는 현 시점에서 WHO 2016 책자가 출간되기 전인 관계로 기존 WHO 2008 분류 기준으로 임상적 특성 등에 대해서 기술하였음.)
1. PDGFRA 클론성 호산구증가증에서 PDGFRA 유전자 이상과 연관된 가장 대표적인 유전자재배열은 FIP1L1-PDGFRA rearrangement로서, 4q12의 cryptic(interstitial) deletion에 의해 형성되는 것으로 알려져 있다. 이외에 PDGFRA 유전자는 적어도 6개의 파트너 유전자들(STRN, CDK5RAP2, KIF5B, ETV6, SCAF1 및 BCR)과 특정한 유전자재배열을 형성하는 것으로 보고되었다(Fig. 1). FIP1L1-PDGFRA는 남성에서 더욱 흔한 것으로 알려져 있으며(M:F=~17:1), 주로 발생하는 연령대는 25세에서 55세 사이로 알려져 있다. 임상양상은 일반적으로 CEL로 오지만, 경우에 따라서 acute myeloid leukemia(AML) 혹은 T-lymphoblastic lymphoma(T-LBL)로 나타날 수 있고, CEL 이후에 acute transformation의 형태로 진행하기도 한다. FIP1L1-PDGFRA를 동반하는 CEL은 multisystem disorder로서, 말초혈액과 골수를 침범한다. 말초혈액 내에서의 특징은 현저한 호산구증가증을 보일 뿐만 아니라, 빈혈 및 혈소판감소증 소견을 동반할 수 있다. 골수 내에서는 호산구 및 전구세포들의 증식을 포함한 세포충실도 증가 소견뿐만 아니라 mast cell이 증가될 수 있다. 또한, 호산구의 조직 침윤(tissue infiltration) 및 호산구에서의 싸이토카인 분비에 의해서 심장, 폐, 신경계, 피부 및 소화기계 등에 조직 손상(tissue damage)을 초래할 수 있다. 대부분의 환자에서 비장비대가 동반되며, 심장섬유화 등에 따른 심각한 임상증상이 나타날 수 있다. 혈청내 tryptase가 보통 증가되나, mast cell disease 보다는 덜 현저한 편이다. 또한, 비타민 B12가 현저하게 증가될 수 있다. FIP1L1-PDGFRA 유전자재배열은 cryptic deletion에 의해 형성되므로 염색체검사로는 검출되지 않으나, RT-PCR 혹은 FISH 검사로 확인이 가능하다. PDGFRA 연관 유전자재배열을 가지는 환자의 경우 tyrosine kinase inhibitor(TKI)에 잘 반응하는 것으로 보고되었으며, 심장 손상(cardiac damage)이 일어나지 않은 상태라면 imatinib 치료시 예후가 좋은 것으로 알려져 있다.
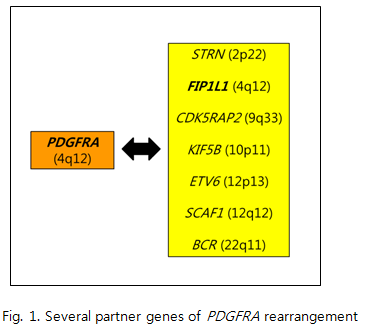
2. PDGFRB 클론성 호산구증가증과 연관된 PDGFRB 유전자는 ETV6 유전자와의 ETV6-PDGFRB 유전자재배열 이외에 적어도 25개의 파트너 유전자들과 특정한 유전자재배열을 형성하는 것으로 알려져 있다(Fig. 2). PDGFRB 연관 유전자재배열은 남성에서 더욱 빈번한 것으로 알려져 있으며(M:F=2:1), 주로 발생하는 연령대는 40대 후반의 중년에서이다. 임상양상은 주로 chronic myelomonocytic leukemia(CMML)의 형태로 오지만, 어떤 환자들은 atypical chronic myeloid leukemia(aCML), MPN이나 AML 등 다양한 형태로 발현될 수 있다. PDGFRB 유전자재배열을 동반하는 CEL은 PDGFRA 이상에서와 마찬가지로 multisystem disorder로서, 말초혈액과 골수를 침범한다. 말초혈액에서는 백혈구 숫자가 증가하고, 빈혈이나 혈소판감소증 등이 동반될 수 있다. 또한, 호중구, 호산구, 단구 및 해당 전구세포들이 다양한 정도로 증가할 수 있으며, 드물게 호염기구의 현저한 증가가 있을 수 있다. 골수 내에서는 활발한 골수구계(호중구, 호산구) 세포들의 증식에 의해서 세포충실도가 증가하고, mast cell 및 reticulin의 증가가 나타날 수 있다. 비장비대가 대부분의 환자에서 동반되며, 간, 심장, 피부 등을 침범해서 간비대나 심장 손상(cardiac damage) 및 심부전(cardiac failure) 등을 초래할 수 있다. 혈청내 tryptase가 경도 혹은 중등도로 증가할 수 있다. 지금까지 보고된 증례들에서 염색체 검사상 5q31~33에서의 breakpoint가 확인되었다. 따라서, 염색체 검사상 PDGFRB 유전자재배열이 의심되는 환자에서 PDGFRB FISH 검사(break-apart FISH with a PDGFRB probe)를 추가적으로 시행하는 것이 진단에 도움이 될 수 있다. FISH 검사로 PDGFRB 유전자재배열이 확인되지 않는 경우 Southern Blot analysis를 진단에 활용할 수 있겠다. imatinib이 사용되기 전 PDGFRB 유전자재배열 환자군의 평균 생존기간은 2년 미만이었다. 그러나, imatinib으로 치료받은 일부 환자에서 65개월 이상의 median survival을 나타내어, PDGFRB 연관 유전자재배열을 가지는 환자의 경우에도 PDGFRA에서와 마찬가지로 TKI에 잘 반응하는 것으로 여겨진다.
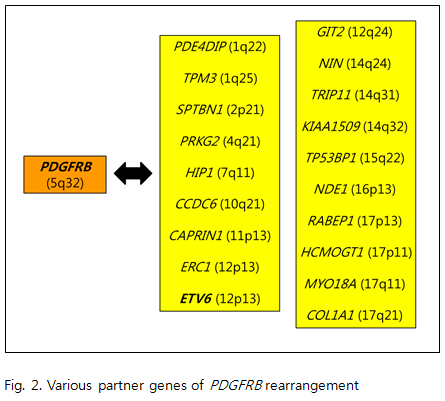
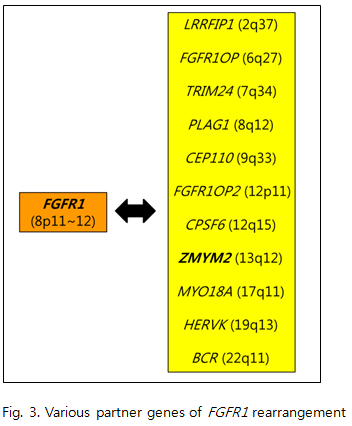
3. FGFR1 클론성 호산구증가증과 연관된 세번째 유전자는 FGFR1로서 적어도 10여개의 파트너 유전자들과 다양한 유전자재배열을 형성하는 것으로 알려져 있다(Fig. 3). 흥미롭게도, FGFR1와 연관된 본 유전자재배열은 FGFR1 유전자의 염색체상 위치(8p11~12) 때문에 과거로부터 “8p11 myeloproliferative syndrome(EMS)”으로 불리워 왔으며, 현재는 독립적인 myeloid/lymphoid neoplasms군으로 분류되고 있다. FGFR1 연관 유전자재배열은 PDGFRA, PDGFRB 유전자 이상과 비교해서 상대적으로 남성에서의 predominance가 뚜렷하지 않으며, 어린이에서부터 노인에 이르기까지 폭넓은 연령대에서 나타났으나 대부분 평균 발병 연령은 30대 초반의 젊은 환자에서 보고되었다. 임상양상은 다양한 형태로 나타날 수 있는데, CEL, AML, T-LBL, 그리고 경우에 따라서 드물게 precursor B lymphoblastic leukemia/lymphoma 로 발현된다(lymphoblastic lymphoma의 경우 t(8;13) 혹은 ZMYM2-FGFR1 유전자재배열을 동반하는 경우에 더욱 흔한 것으로 알려져 있다). 1차적으로 침범하는 기관은 말초혈액, 골수, 림프계, 간 및 비장 등이며, 림프절종대(lymphadenopathy)는 lymphoblasts 혹은 myeloid cells의 침윤의 결과로 나타난다. 약 90%의 환자에서 말초혈액 혹은 골수에서 호산구증가증 소견을 나타낸다. 호염기구증가는 일반적으로 뚜렷하지 않으나, BCR-FGFR1 유전자재배열을 가지는 경우에 동반될 수 있다. FGFR1 유전자재배열을 동반하는 만성기의 환자들은 주로 호산구증가증 및 호중구증가증을 나타내며, 경우에 따라서 단구증가증을 나타낼 수 있다. 또한, 이러한 환자들에서 관찰되는 호산구들은 악성 클론(neoplastic clone)으로 간주되며, 급성기로 넘어가면서(acute transformation) lymphoblasts 혹은 myeloblasts가 동반될 수 있다. PDGFRB 유전자 이상시에서와 마찬가지로 염색체 검사에서 8p11 abnormality를 의심할 수 있으며, FGFR1 유전자재배열이 예상되는 환자에서 FISH 혹은 RT-PCR 검사를 시행하는 것이 확진에 도움을 준다. PDGFRA, PDGFRB 유전자재배열을 동반하는 환자들에서와는 달리 TKI 치료시에 반응하지 않는 것으로 알려져 있으며, 환자들의 예후는 현재까지 좋지 않다. 따라서, 현재 FGFR1 유전자재배열을 동반한 만성기 환자에서는 치료적 옵션으로 조혈모세포이식(stem cell transplantation)을 고려해야 한다.
4. PCM1-JAK2 유전자재배열 클론성 호산구증가증과 관련해서 2016 WHO 분류상 provisional entity로 새롭게 추가된 4번째 유전적 변이는 t(8;9)(p22;p24.1) 혹은 PCM1-JAK2 rearrangement이다. 상기 유전자재배열은 2005년도에 Reiter 등에 의해서 다양한 혈액 질환을 가지는 7명의 남성에서 염색체 이상 및 chimeric fusion gene으로 처음 보고되었으며, 전세계적으로 30례 이상이 알려져 있고, 최근 국내에서는 송 등에 의해서 처음으로 보고되었다. 말초혈액 내에서의 호산구증가증은 흔히 동반되나, 반드시 존재하는 것은 아니다. 흥미롭게도, PDGFRA, PDGFRB 유전자재배열에서와 마찬가지로 남성에서 주로 나타나며(strong male preponderance), 다양한 연령대의 분포를 보이지만 평균 발병 연령은 45-50세 사이로 알려져 있다. 임상양상은 기존 3가지 유전자재배열에서와 마찬가지로 다양한 양상을 나타내며(aCML, AML, CEL, acute erythroid leukemia 혹은 드물게 림프구성 종양 등), 또한 myeloid/lymphoid blast crisis로 진행될 수 있는 위험성이 높다. 염색체 검사를 통해서 t(8;9)의 존재 여부를 의심할 수 있으며, FISH 혹은 RT-PCR 검사를 통해서 PCM1-JAK2 유전자재배열의 확인이 가능하다. 더욱 드물게 t(8;9)의 변이형으로 t(9;12)(p24;p13) 혹은 ETV6-JAK2 유전자재배열이 유사한 임상양상 등으로 보고되었다. 새로운 eosinophilia와 연관된 유전적 이상임에도 불구하고 아직까지 많은 임상 증례들이 알려지지 않아 2016 WHO revision에서 provisional entity로 포함된 것으로 판단되며, 추후 지속적인 임상 연구 결과에 근거해서 향후 full entity로 포함될 것으로 예상된다.
Summary (2016 WHO Classification) 1) 4 clonal markers in myeloid/lymphoid neoplasms associated with eosinophilia and specific gene rearrangements 1. PDGFRA: A MPN with prominent eosinophilia + FIP1L1-PDGFRA fusion gene (주요한 변동없음) 2. PDGFRB: A MPN, often with prominent eosinophilia (neutrophilia, monocytosis) + t(5;12) or ETV6-PDGFRB (주요한 변동없음) 3. FGFR1: A MPN with prominent eosinophilia (neutrophilia, monocytosis) or AML or T/B-ALL presentation + FGFR1 rearrangement (주요한 변동없음) 4. PCM1-JAK2: a new provisional entity 기존의 PDGFRA, PDGFRB, FGFR1 유전자 이상에 추가하여 provisional entity로서 PCM1-JAK2 rearrangement가 본 카테고리에 포함됨(4번째 molecular marker). 2) 진단 관련 세포유전표지자 1. PDGFRA, PDGFRB, FGFR1 관련/: 각각의 유전자는 염색체의 4q12, 5q32 및 8p11 부위에 위치하고 있으며, 드물지만 다양한 종류의 chromosomal translocation과 연관됨. cryptic deletion인 경우(eg. FIP1L1-PDGFRA)를 제외하고 대부분의 경우 염색체 검사에서 존재 여부를 의심할 수 있으며, 각각의 FISH 검사를 통해서 확인 가능함. 2. PCM1-JAK2: t(8;9)(p22;p24.1) 염색체 검사를 통해 존재 여부를 의심할 수 있음. 3) 진단 관련 분자유전표지자 1. PDGFRA, PDGFRB, FGFR1 관련: 각각의 유전자는 다양한 종류의 파트너 유전자들과 gene rearrangement를 형성함. 가장 빈도가 높은 유전자 이상은 cryptic deletion과 연관된 FIP1L1-PDGFRA rearrangement이고, FGFR1-related rearrangement의 경우 해당 유전자의 위치와 연관해서 오랫동안 8p11 myeloproliferative syndrome (EMS) 등으로 불리어 왔음. 각각의 유전자에 대한 FISH 혹은 RT-PCR을 통해서 fusion gene의 존재 여부를 확인할 수 있음. 2. PCM1-JAK2: t(8;9)(p22;p24.1) FISH 혹은 RT-PCR을 통해서 fusion gene의 존재 여부를 확인할 수 있음. 참고문헌
|
Copyright © The Korea Society for Laboratory Hematology. All Rights Reserved.
|